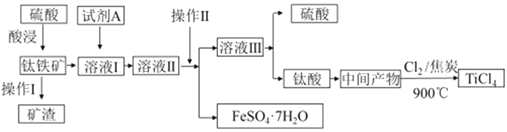
题目内容
【题目】电解原理和原电池原理是电化学的两个重要内容.某兴趣小组做如下探究实验:

(1)如图1为某实验小组依据氧化还原反应设计的原电池装置,该反应的离子方程式为__________________,反应前两电极质量相等,一段时间后,两电极质量相差15g,导线中通过__mol电子.
(2)如图1,其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极的电极反应式为___________________________________,这是由于NH4Cl溶液显____性,用离子方程式表示溶液显此性的原因__________________________________________
(3)如图2,其他条件不变,若将盐桥换成弯铜导线与石墨相连成∩型,则乙装置中石墨电极(1)为__极,甲装置中铜电极上电极反应式为_____

(4)如图2乙装置中改为加入400mL CuSO4溶液,一段时间后,若电极质量增重1.28g,则此时溶液的pH为__
【答案】 Fe+Cu2+==Cu+Fe2+ 0.25 2H++2e- == H2↑或 2NH4++2e-==H2↑+2NH3 酸 NH4++H2O![]() NH3·H2O+H+ 阴 O2+4e-+2H2O==4OH- 1
NH3·H2O+H+ 阴 O2+4e-+2H2O==4OH- 1
【解析】试题分析:本题考查原电池原理和电解池原理,电化学的有关计算。
(1)Fe为负极,Fe极的电极反应式为Fe-2e-=Fe2+,石墨为正极,石墨极的电极反应式为Cu2++2e-=Cu,反应的离子方程式为Fe+Cu2+=Fe2++Cu。若反应前两电极质量相等,根据电子守恒,电路中每通过2mol电子,负极减少1molFe(56gFe),正极增加1molCu(64gCu),即电路中每通过2mol电子,两极质量相差56g+64g=120g,则两极质量相差15g时导线中通过的电子为![]() 2mol=0.25mol。
2mol=0.25mol。
(2)若将CuCl2溶液换为NH4Cl溶液,石墨为正极,石墨电极的电极反应式为2H++2e-=H2↑(或2NH4++2e-=H2↑+2NH3)。NH4Cl属于强酸弱碱盐,由于NH4+的水解,NH4Cl溶液呈酸性,NH4+水解的离子方程式为NH4++H2O![]() NH3·H2O+H+。
NH3·H2O+H+。
(3)其他条件不变,若将盐桥换成弯铜导线与石墨相连成∩型,此时甲装置为原电池,乙装置为电解池,由于Fe比Cu活泼,甲装置中Fe为负极,Cu为正极,则乙装置中的石墨(1)为阴极,石墨(2)为阳极。甲装置中溶液为NaCl溶液,溶液呈中性,甲为铁的吸氧腐蚀,Cu极的电极反应式为O2+4e-+2H2O=4OH-。
(4)如图2乙装置中改为加入400mL CuSO4溶液,装置乙中电解的离子方程式为2Cu2++2H2O![]() 2Cu+4H++O2↑,若电极质量增重1.28g即n(Cu)=
2Cu+4H++O2↑,若电极质量增重1.28g即n(Cu)=![]() =0.02mol,则反应生成n(H+)=0.04mol,c(H+)=
=0.02mol,则反应生成n(H+)=0.04mol,c(H+)=![]() =0.1mol/L,溶液的pH=-lgc(H+)=1。
=0.1mol/L,溶液的pH=-lgc(H+)=1。