题目内容
【题目】碳及其化合物在有机合成、能源开发等工农业方面具有十分广泛的应用。
I.工业生产精细化工产品乙二醛(OHC-CHO)
(1)乙醇(CH3CH2OH)液相硝酸氧化法:在Cu(NO3)2催化下,用稀硝酸氧化乙醇制取乙二醛,此反应的化学方程式为_______________。该法具有原料易得、反应条件温和等优点,但也存在比较明显的缺点____________。
(2)乙二醇(HOCH2CH2OH)气相氧化法
已知:2H2(g)+O2(g) ![]() 2H2O(g)ΔH=-484kJ/mol,化学平衡常数为K1
2H2O(g)ΔH=-484kJ/mol,化学平衡常数为K1
OHC-CHO(g)+2H2(g) ![]() HOCH2CH2OH(g) ΔH=-78kJ/mol,化学平衡常数为K2
HOCH2CH2OH(g) ΔH=-78kJ/mol,化学平衡常数为K2
则乙二醇气相氧化反应HOCH2CH2OH(g)+O2(g) ![]() OHC-CHO(g)+2H2O(g)的ΔH=______;相同温度下,该反应的化学平衡常数K=______(用含K1、K2的代数式表示)。
OHC-CHO(g)+2H2O(g)的ΔH=______;相同温度下,该反应的化学平衡常数K=______(用含K1、K2的代数式表示)。
Ⅱ.CO2的综合利用
(3)一定量的CO2与足量的碳在体积可变的恒压密闭容器中发生反应C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示,则下列说法正确的是______(填字母)。
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示,则下列说法正确的是______(填字母)。
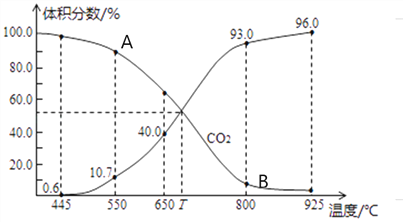
a.反应达平衡状态时,混合气体的平均相对分子质量保持不变
b.A点的正反应速率比B点正反应速率小
C.550℃时,若充入氦气,则V正、V逆均减小,平衡不移动
d.T℃时,反应达平衡后CO2的转化率为66.7%
e. T℃时,若再充入1molCO2和1molCO,平衡不移动
(4)氨气、CO2在一定条件下可合成尿素,其反应为2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g),右图表示合成塔中氨碳比a与CO2转化率ω的关系。a为{n(NH3)/n(CO2)},b为水碳比{n(H2O)/n(CO2)}。则
CO(NH2)2(s)+H2O(g),右图表示合成塔中氨碳比a与CO2转化率ω的关系。a为{n(NH3)/n(CO2)},b为水碳比{n(H2O)/n(CO2)}。则
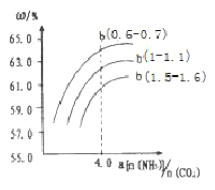
①b应控制在______
a.1.5-1.6b.1-1.1c.0.6-0.7
②a应控制在4.0的理由是_________
【答案】 CH2CH2OH+2HNO3![]() OHC-CHO+2NO↑+3H2O 硝酸会腐蚀设备,生成的NO会污染空气 -406kJ/mol K1/K2 abe c 氨碳比a<4.0时CO2转化率较小;氨碳比a>4.0时CO2转化率增加不明显且浪费原料
OHC-CHO+2NO↑+3H2O 硝酸会腐蚀设备,生成的NO会污染空气 -406kJ/mol K1/K2 abe c 氨碳比a<4.0时CO2转化率较小;氨碳比a>4.0时CO2转化率增加不明显且浪费原料
【解析】试题分析:本题考查化学方程式的书写、盖斯定律的应用、化学平衡图像的分析、化学平衡常数。
I.(1)稀HNO3将CH3CH2OH氧化成OHC-CHO,稀HNO3自身被还原成NO,CH3CH2OH中C的平均化合价为-2价,OHC-CHO中C的平均化合价为+1价,N元素的化合价由+5价降为+2价,根据得失电子守恒和原子守恒,反应的化学方程式为CH3CH2OH+2HNO3(稀)![]() OHC-CHO+2NO↑+3H2O。根据反应,该方法比较明显的缺点是:HNO3会腐蚀设备,生成的NO会污染空气。
OHC-CHO+2NO↑+3H2O。根据反应,该方法比较明显的缺点是:HNO3会腐蚀设备,生成的NO会污染空气。
(2)将反应编号,2H2(g)+O2(g)![]() 2H2O(g)ΔH=-484kJ/mol(①式)
2H2O(g)ΔH=-484kJ/mol(①式)
OHC-CHO(g)+2H2(g)![]() HOCH2CH2OH(g)ΔH=-78kJ/mol(②式)
HOCH2CH2OH(g)ΔH=-78kJ/mol(②式)
应用盖斯定律,①式-②式得HOCH2CH2OH(g)+O2(g)![]() OHC-CHO(g)+2H2O(g)ΔH=(-484kJ/mol)-(-78kJ/mol)=-406kJ/mol。根据化学平衡常数的含义,K1=
OHC-CHO(g)+2H2O(g)ΔH=(-484kJ/mol)-(-78kJ/mol)=-406kJ/mol。根据化学平衡常数的含义,K1=![]() ,K2=
,K2=![]() ,反应HOCH2CH2OH(g)+O2(g)
,反应HOCH2CH2OH(g)+O2(g)![]() OHC-CHO(g)+2H2O(g)的化学平衡常数K=
OHC-CHO(g)+2H2O(g)的化学平衡常数K=![]() =
=![]() 。
。
II.(3)a项,开始时气体只有CO2,CO2的相对分子质量为44,建立平衡过程中生成CO,混合气体的平均相对分子量减小,达到平衡时混合气体的平均相对分子质量保持不变,a项正确;b项,A点温度低于B点温度,A点的正反应速率比B点正反应速率小,b项正确;c项,该容器为体积可变的恒压容器,550℃时若充入He气,容器体积增大,υ正、υ逆均减小,平衡向正反应方向移动,c项错误;d项,设起始CO2物质的量为amol,从起始到平衡时转化CO2物质的量为xmol,转化CO物质的量为2xmol,平衡时CO2、CO物质的量分别为(a-x)mol、2xmol,根据图像T℃达到平衡时CO2和CO的体积分数相等,则(a-x)mol=2xmol,解得x=![]() ,达到平衡后CO2的转化率为
,达到平衡后CO2的转化率为![]() 100%=33.3%,d项错误;e项,根据图像T℃达到平衡时CO2和CO的体积分数相等,CO2和CO物质的量相等,若再充入1molCO2和1molCO,瞬时CO2和CO的体积分数仍相等,处于平衡状态,平衡不移动,e项正确;答案选abe。
100%=33.3%,d项错误;e项,根据图像T℃达到平衡时CO2和CO的体积分数相等,CO2和CO物质的量相等,若再充入1molCO2和1molCO,瞬时CO2和CO的体积分数仍相等,处于平衡状态,平衡不移动,e项正确;答案选abe。
(4)①根据图像在相同氨碳比时,水碳比在0.6-0.7时CO2的转化率最大,b应控制在0.6-0.7,答案选c。
②根据图像,氨碳比a<4.0时CO2转化率较小;氨碳比a>4.0时CO2转化率增加不明显且浪费原料,所以a应控制在4.0。

 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案