题目内容
【题目】请按下列要求填空:
(1)已知:99 ℃时,水的离子积常数Kw=1.0×10-12,该温度下测得0.1 mol·L-1 Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为_________________________。
②体积相等、pH=1的盐酸与H2A溶液分别与足量Zn反应,产生的氢气___(填编号)。
A.盐酸多 B.H2A多 C.一样多 D.无法确定
③将0.1 mol·L-1 H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为__________________________________。
(2)已知:25 ℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO |
电离平 衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K=3.2×10-8 |
请回答下列问题:
①物质的量浓度为0.1 mol/L的下列四种物质:
a.Na2CO3 b.NaClO c.CH3COONa d.NaHCO3
pH由大到小的顺序是________________________________(填编号)。
②常温下0.1 mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变大的是______(填编号)。
A.c(H+) B. ![]() C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.![]()
③写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:________。
④25 ℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=_______(填准确数值)。
⑤25 ℃时,将a mol/L的醋酸与b mol/L氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为_______________。
【答案】 H2A===2H++A2- C c(NH)>c(A2-)>c(H+)>c(OH-) a>b>d>c B、D ClO-+CO2+H2O===HCO+HClO 9.9×10-7 mol/L ![]()
【解析】(1)已知:99 ℃时,水的离子积常数Kw=1.0×10-12,c(OH-)= c(H+)=10-6mol/L,该温度下测得0.1 mol·L-1 Na2A溶液的pH=6,则溶液呈中性,Na2A为强酸强碱盐,H2A为强酸。①H2A在水溶液中的电离方程式为H2A=2H++A2-;②体积相等、pH=1的盐酸与H2A溶液n(H+)相等,分别与足量Zn反应产生的氢气一样多,答案选C;③将0.1 mol·L-1 H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后为(NH4)2A溶液,(NH4)2A是强酸弱碱盐,水解呈酸性,溶液中各离子浓度从大到小的顺序为:c(NH)>c(A2-)>c(H+)>c(OH-);(2)①由电离平衡常数判断酸性的强弱,酸性越强,其对应盐的水解程度越大,溶液的pH就越大,由表格中的数据可知,酸性CH3COOH>H2CO3>HClO>HCO3-,则水解程度为a>b>d>c,pH由大到小的顺序是a>b>d>c;(2)A.CH3COOH溶液加水稀释过程,促进电离,c(H+)减小,选项A不选;B.稀释过程中电离平衡CH3COOH![]() CH3COO-+H+正向移动,
CH3COO-+H+正向移动, ![]() =
=![]() ,则稀释过程中比值变大,选项B选;C.稀释过程,促进电离,c(H+)减小,c(OH-)增大,c(H+)c(OH-)=Kw,Kw不变,选项C不选;D.稀释过程,促进电离,c(H+)减小,c(OH-)增大,则
,则稀释过程中比值变大,选项B选;C.稀释过程,促进电离,c(H+)减小,c(OH-)增大,c(H+)c(OH-)=Kw,Kw不变,选项C不选;D.稀释过程,促进电离,c(H+)减小,c(OH-)增大,则![]() 变大,选项D选。答案选BD;③电离常数越大,酸性越强,因此酸性强弱为H2CO3>HClO>HCO3-,故向次氯酸钠溶液中通入少量二氧化碳的离子方程式为:ClO-+CO2+H2O= HCO3-+HClO;④根据电荷守恒得c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=10-6 mol/L-10-8 mol/L=9.9×10-7 mol/L;⑤25 ℃时,将a mol/L的醋酸与b mol/L氢氧化钠等体积混合,反应后溶液恰好显中性,此时c(H+)=c(OH-)=10-7 mol/L,c(CH3COO-)=c(Na+)=
变大,选项D选。答案选BD;③电离常数越大,酸性越强,因此酸性强弱为H2CO3>HClO>HCO3-,故向次氯酸钠溶液中通入少量二氧化碳的离子方程式为:ClO-+CO2+H2O= HCO3-+HClO;④根据电荷守恒得c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=10-6 mol/L-10-8 mol/L=9.9×10-7 mol/L;⑤25 ℃时,将a mol/L的醋酸与b mol/L氢氧化钠等体积混合,反应后溶液恰好显中性,此时c(H+)=c(OH-)=10-7 mol/L,c(CH3COO-)=c(Na+)=![]() mol/L,剩余的c(CH3COOH)=
mol/L,剩余的c(CH3COOH)= ![]() mol/L,则醋酸的电离平衡常数Ka=
mol/L,则醋酸的电离平衡常数Ka=![]() =
=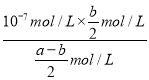 =
=![]() 。
。