题目内容
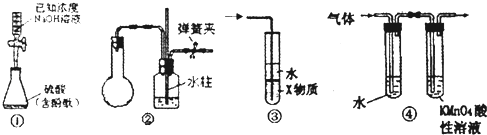
【题目】某课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下4组实验,如图Ⅰ~Ⅳ所示.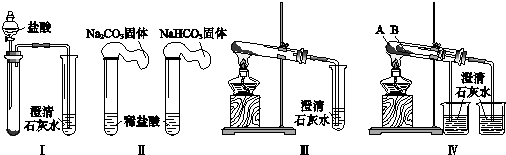
(1)Ⅱ所示的实验,若固体质量相同且稀盐酸足量时,气球鼓起较小的是(填化学式).
(2)Ⅲ、Ⅳ所示的实验均能鉴别这两种物质,相关反应的化学方程式是 . 与Ⅲ相比,IV的优点是(填选项序号).a.Ⅳ比Ⅲ复杂 b.Ⅳ比Ⅲ安全
c.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行
(3)若用Ⅳ验证碳酸钠和碳酸氢钠的热稳定性,则试管B中装入的固体应该是 .
【答案】
(1)Na2CO3
(2)2NaHCO3 ![]() Na2CO3+CO2↑+H2O;CO2+Ca(OH)2═CaCO3↓+H2O;c
Na2CO3+CO2↑+H2O;CO2+Ca(OH)2═CaCO3↓+H2O;c
(3)NaHCO3
【解析】解:(1)稀盐酸足量说明两种固体完全反应,质量相同含碳量越高,完全反应生成二氧化碳的量越多,碳酸钠中含碳量为 ![]() =11.3%,而碳酸氢钠中含碳量为
=11.3%,而碳酸氢钠中含碳量为 ![]() =14.3%,所以碳酸钠放出二氧化碳量少,故答案为:Na2CO3;(2)碳酸氢钠在加热条件下能分解生成碳酸钠和水、二氧化碳2NaHCO3
=14.3%,所以碳酸钠放出二氧化碳量少,故答案为:Na2CO3;(2)碳酸氢钠在加热条件下能分解生成碳酸钠和水、二氧化碳2NaHCO3 ![]() Na2CO3+CO2↑+H2O;CO2+Ca(OH)2═CaCO3↓+H2O;实验Ⅲ、Ⅳ相比,IV可以做到一套装置同时进行两个对比实验,而III不能,故选c,故答案为:2NaHCO3
Na2CO3+CO2↑+H2O;CO2+Ca(OH)2═CaCO3↓+H2O;实验Ⅲ、Ⅳ相比,IV可以做到一套装置同时进行两个对比实验,而III不能,故选c,故答案为:2NaHCO3 ![]() Na2CO3+CO2↑+H2O,CO2+Ca(OH)2═CaCO3↓+H2O;c;(3)碳酸钠直接加热不产生气体,而碳酸氢钠不直接加热就产生气体,就更说明碳酸氢钠不稳定,所以试管B中装入的固体最好是碳酸氢钠.故答案为:NaHCO3 . (1)稀盐酸足量说明两种固体完全反应,质量相同含碳量越高,完全反应生成二氧化碳的量越多;(2)碳酸氢钠在加热条件下能分解生成碳酸钠和水、二氧化碳;根据两个实验的区别分析;(3)根据碳酸氢钠的性质分析.
Na2CO3+CO2↑+H2O,CO2+Ca(OH)2═CaCO3↓+H2O;c;(3)碳酸钠直接加热不产生气体,而碳酸氢钠不直接加热就产生气体,就更说明碳酸氢钠不稳定,所以试管B中装入的固体最好是碳酸氢钠.故答案为:NaHCO3 . (1)稀盐酸足量说明两种固体完全反应,质量相同含碳量越高,完全反应生成二氧化碳的量越多;(2)碳酸氢钠在加热条件下能分解生成碳酸钠和水、二氧化碳;根据两个实验的区别分析;(3)根据碳酸氢钠的性质分析.

【题目】请按下列要求填空:
(1)已知:99 ℃时,水的离子积常数Kw=1.0×10-12,该温度下测得0.1 mol·L-1 Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为_________________________。
②体积相等、pH=1的盐酸与H2A溶液分别与足量Zn反应,产生的氢气___(填编号)。
A.盐酸多 B.H2A多 C.一样多 D.无法确定
③将0.1 mol·L-1 H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为__________________________________。
(2)已知:25 ℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO |
电离平 衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K=3.2×10-8 |
请回答下列问题:
①物质的量浓度为0.1 mol/L的下列四种物质:
a.Na2CO3 b.NaClO c.CH3COONa d.NaHCO3
pH由大到小的顺序是________________________________(填编号)。
②常温下0.1 mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变大的是______(填编号)。
A.c(H+) B. ![]() C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.![]()
③写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:________。
④25 ℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=_______(填准确数值)。
⑤25 ℃时,将a mol/L的醋酸与b mol/L氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为_______________。
【题目】下列各选项中的两个反应,可用同一个离子方程式表示的是( )
选项 | Ⅰ | Ⅱ |
A | Ba(OH)2溶液与过量NaHCO3溶液混合 | NaOH溶液与过量NaHCO3溶液混合 |
B | 少量SO2通入Ba(OH)2溶液中 | 过量SO2通入Ba(OH)2溶液中 |
C | BaCl2溶液与Na2SO3溶液混合 | Ba(OH)2溶液与H2SO3溶液混合 |
D | 少量NaHCO3溶液滴入澄清石灰水中 | 少量NaOH溶液滴入Ca(HCO3)2溶液中 |
A.A
B.B
C.C
D.D