题目内容
1.下列关于反应过程中能量变化的表达正确的是( )| A. | 丁烷的燃烧热是2878 kJ/mol,则表示丁烷燃烧热的热化学方程式为:C4H10(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(g)△H=-2878 kJ/mol | |
| B. | 己知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2.则△H1>△H2 | |
| C. | 已知①2H2(g)+O2(g)═2H2O(g)△H1=a kJ•mol-1,②2H2(g)+O2(g)═2H2O(l)△H2=b kJ•mol-1,则a<b | |
| D. | 在一定条件下,某可逆反应的△H=+100 kJ•mol-1,则该反应正反应活化能比逆反应活化能大100 kJ•mol-1 |
分析 A、燃烧热是1mol物质完全燃烧生成稳定氧化物放出热量,应该生成液态水;
B、碳燃烧生成CO及一氧化碳燃烧生成二氧化碳都会放热;
C、根据物质的不同聚集状态判断反应热的大小;
D、正反应与逆反应的活化能之差为△H.
解答 解:A、燃烧热是1mol物质完全燃烧生成稳定氧化物放出热量,应该生成液态水,故A错误;
B、一氧化碳燃烧生成二氧化碳会放热,焓变为负值,则△H1<△H2,故B错误;
C、物质的聚集状态不同,放出的热量不同,水蒸气液化时放热,则有|△H1|<|△H2|,由于氢气的燃烧为放热反应,△H<0,则a>b,故C错误;
D、正反应的活化能-逆反应的活化能即为该反应的焓变数值,在一定条件下,某可逆反应的△H=+100kJ•mol-1,则该反应正反应活化能比逆反应活化能大100kJ•mol-1,故D正确.
故选:D.
点评 本题考查了化学反应焓变的分析判断,燃烧热的定义的分析,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
12.证明溶液中是否含有Fe2+,其操作可以是①加入少量KMnO4溶液;②滴入少许KSCN溶液;③加入少许氯水.其中正确的是( )
| A. | 先①后② | B. | 先②后① | C. | 先②后③ | D. | 先③后② |
12.在下列概念中,前者不包括后者的是( )
| A. | 氧化物、酸性氧化物 | B. | 化合物、电解质 | ||
| C. | 氧化还原反应、复分解反应 | D. | 氧化还原反应、置换反应 |
9.莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是( ) 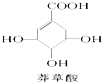

| A. | 分子式为C7H6O5 | |
| B. | 分子中含有三种官能团 | |
| C. | 可发生加成和取代反应 | |
| D. | 在水溶液中羧基和羟基均能电离出H+ |
13.丙烯醇在一定条件下可转化为丙烯醛:CH2=CHCH2OH$→_{25℃}^{新型MnO_{2}}$CH2=CHCHO+H2,下列有关说法错误的是( )
| A. | 丙烯醇与丙醛(CH3CH2CHO)互为同分异构体 | |
| B. | 丙烯醇、丙烯醛均含有两种官能团 | |
| C. | 1 mol丙烯醛可以和2 mol氢气发生加成反应 | |
| D. | 此转化过程中丙烯醇被还原 |
11.能正确表示下列化学反应的离子方程式是( )
| A. | Na与H2O反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 工业制备氯气:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2Na++2OH-+H2↑+Cl2↑ | |
| C. | 碳酸钙与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | Cl2与H2O反应:Cl2+H2O═2H++Cl-+ClO- |
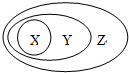 如图表示的一些物质或概念间的关系,下列与该关系一致的是( )
如图表示的一些物质或概念间的关系,下列与该关系一致的是( )