题目内容
对大气污染物SO2、NOx进行研究具有重要环保意义。请回答下列问题:
(1)为减少SO2的排放,常采取的措施是将煤转化为清洁气体燃料。
已知:H2(g)+ O2(g)=H2 O(g) △H=-241.8kJ·mol-1
O2(g)=H2 O(g) △H=-241.8kJ·mol-1
C(s)+ O2(g)=CO(g) △H=-110.5kJ·mol-1
O2(g)=CO(g) △H=-110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式: 。
(2)已知汽缸中生成NO的反应为:N2(g)+O2(g) 2NO(g) △H
2NO(g) △H 0,若1.0 mol空气含0.80 mol N2和0.20 mol O2,1300oC时在1.0 L密闭容器内经过5s反应达到平衡,测得NO为8.0×10-4 mol。
0,若1.0 mol空气含0.80 mol N2和0.20 mol O2,1300oC时在1.0 L密闭容器内经过5s反应达到平衡,测得NO为8.0×10-4 mol。
①5s内该反应的平均速率ν(NO) = (保留2位有效数字);在1300oC 时,该反应的平
衡常数表达式K= 。
②汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是 。
(3)汽车尾气中NO和CO的转化。当催化剂质量一定时,增大催化剂固体的表面积可提高化学反应速率。右图表示在其他条件不变时,反应2NO(g)+2CO(g) 2CO2(g)+N2(g) 中,NO的浓度
2CO2(g)+N2(g) 中,NO的浓度
c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
①该反应的△H 0 (填“>”或“<”)。
②若催化剂的表面积S1>S2,在右图中画出c(NO) 在T1、S2条件下达到平衡过程中的变化曲线(并作相应标注)。
(1)C(s) + H2O(g) = CO(g) + H2(g) △H=+131.3kJ·mol-1 (3分,化学式、状态错误0分;焓变数值、单位错漏扣1分;计量数用分数表示与焓变相匹配也给分)
(2)①1.6×10-4 mol/(L·s)(2分,单位或有效数字错漏扣1分); (2分)
(2分)
② 温度升高,反应速度加快(2分),平衡向右移动(2分)
(3)① <(2分) ②见图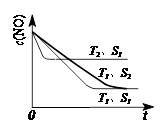 :(3分,其中曲线2分,标注1分)
:(3分,其中曲线2分,标注1分)
解析试题分析:(1)已知:①H2(g)+ O2(g)=H2 O(g) △H=-241.8kJ·mol-1,②C(s)+
O2(g)=H2 O(g) △H=-241.8kJ·mol-1,②C(s)+ O2(g)=CO(g) △H=-110.5kJ·mol-1,则根据盖斯定律可知②-①即得到热化学方程式C(s) + H2O(g) = CO(g) + H2(g),所以该反应的反应热△H=-110.5kJ·mol-1+241.8kJ·mol-1=+131.3kJ·mol-1。
O2(g)=CO(g) △H=-110.5kJ·mol-1,则根据盖斯定律可知②-①即得到热化学方程式C(s) + H2O(g) = CO(g) + H2(g),所以该反应的反应热△H=-110.5kJ·mol-1+241.8kJ·mol-1=+131.3kJ·mol-1。
(2)①1300oC时在1.0 L密闭容器内经过5s反应达到平衡,测得NO为8.0×10-4 mol,则反应中生成NO的浓度是8.0×10-4 mol/L,因此5s内该反应的平均速率ν(NO)=8.0×10-4 mol/L÷5s=1.6×10-4 mol/(L·s)。化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据方程式N2(g)+O2(g) 2NO(g)可知,该温度下该反应的平衡常数表达式K=
2NO(g)可知,该温度下该反应的平衡常数表达式K= 。
。
②N2(g)+O2(g) 2NO(g) △H
2NO(g) △H 0,这说明该反应是吸热反应。升高温度,反应速率增大,平衡向正反应方向移动,因此NO的排放量增大。
0,这说明该反应是吸热反应。升高温度,反应速率增大,平衡向正反应方向移动,因此NO的排放量增大。
(3)①根据图像可知,在固体催化剂的表面积不变的情况下,温度为T2的曲线首先达到平衡状态。温度高反应速率快,到达平衡的时间少。因此温度是T2>T1。但温度高平衡时NO的浓度大,这说明升高温度平衡向逆反应方向移动,因此正方应是放热反应,即△H<0。
②当质量一定时,增大固体催化剂的表面积可提高化学反应速率,但催化剂不能改变平衡状态。所以若催化剂的表面积S1>S2,则在温度为T1时,达到平衡的时间增加,但平衡状态不变,因此图像为 。
。
考点:考查热化学方程式的书写、反应速率的计算、平衡常数表达式、外界条件对平衡状态的影响以及图像识别

碳、氮和铝的单质及其化合物在工农业生产和生活中有重要作用。
(1)真空碳热还原一氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
2Al2O3(s)+ 2AlCl3(g)+ 6C(s)=6AlCl(g)+ 6CO(g);△H= a kJ?mol-1
3AlCl(g)= 2Al(l)+ AlCl3(g);△H= b kJ?mol-1
反应Al2O3(s)+ 3C(s)= 2Al(l)+ 3CO(g)的△H= kJ?mol-1
(用含a、b的代数式表示)。
(2)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+ 2NO(g) N2(g)+ CO2(g);△H= Q kJ?mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+ CO2(g);△H= Q kJ?mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 时间(min) 浓度(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
①0~10min内,NO的平均反应速率v(NO)= ,T1℃时,该反应的平衡常数K=
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母编号)
a.通入一定量的NO b.加入一定量的活性炭
c.加入合适的催化剂 d.适当缩小容器的体积
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,则Q 0(填“>”或“<”)。
④在恒容绝热条件下,能判断该反应一定达到化学平衡状态的依据是 (填选项编号)
a.单位时间内生成2nmol NO(g)的同时消耗nmol CO2(g)
b.反应体系的温度不再发生改变
c.混合气体的密度不再发生改变
碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用。
(1)真空碳热还原—氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
①2Al2O3(s)+2AlCl3(g)+6C(s) = 6AlCl(g)+6CO(g) ΔH=a kJ·mol-1
②3AlCl(g) = 2Al(l)+AlCl3(g) ΔH=b kJ·mol-1
反应:Al2O3(s)+3C(s)=2Al(l)+3CO(g)的ΔH = kJ·mol-1 (用含a、b的代数式表示);
(2)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)  N2(g)+CO2(g) ΔH ="Q" kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) ΔH ="Q" kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 时间/min 浓度/mol/L | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
①0~10 min内,NO的平均反应速率v(NO)= ,T1℃时,该反应的平衡常数= 。
②30 min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母编号)。
A.通入一定量的NO B.加入一定量的活性炭
C.加入合适的催化剂 D.适当缩小容器的体积
③在恒容条件下,能判断该反应一定达到化学平衡状态的依据是 (填选项编号)。
A.单位时间内生成2 n mol NO(g)的同时消耗n mol CO2(g)
B.反应体系的温度不再发生改变
C.混合气体的密度不再发生改变
D 反应体系的压强不再发生改变
研究二氧化硫、氮氧化物、PM2.5等大气污染物的治理具有重要意义。
(1)对PM2.5样本用蒸馏水处理制成待测试样。若测得该试样中除H+和OH﹣外其它水溶性离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3﹣ | Cl﹣ |
| 浓度/mol·L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断试样的pH =
(2)含SO2的工业废气处理:废气的将含有SO2的废气通过装有石灰石浆液的脱硫装置可以除去其中的二氧化硫,在废气脱硫的过程中,所用的石灰石浆液在进入脱硫装置前,需通一段时间的二氧化碳,以增加其脱硫效率;脱硫时控制浆液的pH值,此时浆液含有的亚硫酸氢钙可以被氧气快速氧化生成硫酸钙。
二氧化碳与石灰石浆液反应得到的产物为 。
亚硫酸氢钙被足量氧气氧化生成硫酸钙的化学方程式为 。
(3)汽车尾气中NOx和CO的生成及转化。
①已知气缸中生成NO的反应为:N2(g)+O2(g)
 2NO(g)
2NO(g)  H>0
H>0汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是 。
②在汽车尾气系统中安装催化转化器,使NO和CO迅速发生反应转化成对环境无污染的气体,可减少CO和NO的污染,反应的化学方程式为 。
(4)用CH4催化还原NOx可消除氮的氧化物的污染。例如:
CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g)△H=-574kJ·mol—1
CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ·mol—1
H2O(g)= H2O(l)△H=-144kJ·mol—1
取标准状况下4.48LCH4还原NO2和NO的混合物,若氮氧化物完全被还原,且生成H2O(l),则放出的总热量Q的取值范围是 。

 2NO2(g);△H=" +57.0" kJ·mol-1,NO2和N2O4的浓度如图甲所示。NO2和N2O4的消耗速率与其浓度的关系如乙图所示,
2NO2(g);△H=" +57.0" kJ·mol-1,NO2和N2O4的浓度如图甲所示。NO2和N2O4的消耗速率与其浓度的关系如乙图所示,