��Ŀ����
�о��������������PM2.5�ȴ�����Ⱦ�������������Ҫ���塣
��1����PM2.5����������ˮ�����Ƴɴ�������������ø������г�H+��OH��������ˮ�������ӵĻ�ѧ��ּ���ƽ��Ũ�����±���
| ���� | K+ | Na+ | NH4+ | SO42- | NO3�� | Cl�� |
| Ũ��/mol��L-1 | 4��10-6 | 6��10-6 | 2��10-5 | 4��10-5 | 3��10-5 | 2��10-5 |
���ݱ��������ж�������pH =
��2����SO2�Ĺ�ҵ���������������Ľ�����SO2�ķ���ͨ��װ��ʯ��ʯ��Һ������װ�ÿ��Գ�ȥ���еĶ��������ڷ�������Ĺ����У����õ�ʯ��ʯ��Һ�ڽ�������װ��ǰ����ͨһ��ʱ��Ķ�����̼��������������Ч�ʣ�����ʱ���ƽ�Һ��pHֵ����ʱ��Һ���е���������ƿ��Ա���������������������ơ�
������̼��ʯ��ʯ��Һ��Ӧ�õ��IJ���Ϊ ��
��������Ʊ���������������������ƵĻ�ѧ����ʽΪ ��
��3������β����NOx��CO�����ɼ�ת����
����֪����������NO�ķ�ӦΪ��N2(g)+O2(g��
 2NO(g��
2NO(g��  H��0
H��0���������������¶�Խ�ߣ���λʱ����NO�ŷ���Խ��ԭ���� ��
��������β��ϵͳ�а�װ��ת������ʹNO��COѸ�ٷ�����Ӧת���ɶԻ�������Ⱦ�����壬�ɼ���CO��NO����Ⱦ����Ӧ�Ļ�ѧ����ʽΪ ��
��4����CH4����ԭNOx�������������������Ⱦ�����磺
CH4(g)��4NO2(g���� 4NO(g)��CO2(g)��2H2O(g����H����574kJ��mol��1
CH4(g)��4NO(g���� 2N2(g)��CO2(g)��2H2O(g����H����1160kJ��mol��1
H2O(g���� H2O(l����H����144kJ��mol��1
ȡ��״����4.48LCH4��ԭNO2��NO�Ļ���������������ȫ����ԭ��������H2O(l)����ų���������Q��ȡֵ��Χ�� ��
��1��4 (3��)
��2��Ca(HCO3)2��̼�����(2�֣� Ca(HSO3)2 + O2 = CaSO4 + H2SO4(2��)
��3�����¶����ߣ���Ӧ���ʼӿ죬��ƽ��������Ӧ�����ƶ�(2��)
��2CO + 2NO  2CO2 + N2 (2��)
2CO2 + N2 (2��)
��4��191kJ��Q��249.6kJ��4�֣�
���������������1���۲�����з���NH4��ˮ�������ԣ�PM2.5�������Ϊ���ԡ�������pHֵ������Һ�е���غ����H������Ũ��Ϊ10-4��PHֵΪ4��
��2��CO2��CaCO3��Ӧ�������ܵ�Ca(HCO3)2����������ƾ��л�ԭ�ԣ��ɱ�����Ϊ����ƣ���Ӧ�ķ���ʽΪCa(HSO3)2 + O2 = CaSO4 + H2SO4��
��3���������¶�Խ�ߣ���λʱ����NO�ŷ���Խ��ԭ�����¶����ߣ���Ӧ���ʼӿ죬ƽ�����ƣ�
������β��ϵͳ��װ�÷�Ӧ�Ļ�ѧ����ʽΪ 2CO + 2NO  2CO2 + N2��
2CO2 + N2��
��4����CH4��g��+4NO2��g��=4NO��g��+CO2��g��+2H2O��l����H=��574kJ?mol-1
��CH4��g��+4NO��g��=2N2��g��+CO2��g��+2H2O��g����H=��1160kJ?mol-1
��H2O��g��=H2O��l����H=��44.0kJ?mol-1
�ɸ�˹���ɢ�+��+�ۡ�2�õ���CH4��g��+4NO2��g��=4NO��g��+CO2��g��+2H2O��l������H="-1910" kJ?mol-1��
���Ȼ�ѧ����ʽΪ����CH4��g��+2NO2��g��=N2��g��+CO2��g��+2H2O��l������H=��955 kJ?mol-1��
�ɸ�˹���ɢ�+�ۡ�2�õ�����CH4��g��+4NO��g��=2N2��g��+CO2��g��+2H2O��g����H=��1248kJ?mol-1
��״����4.48LCH4���ʵ���Ϊ0.2mol���ü��������ȫ�����բܣ��ų�����191kJ�����ȫ�����բݣ��ų�����249.6kJ������Q��ȡֵ��Χ��191kJ��Q��249.6kJ��
���㣺���黯ѧ��Ӧԭ���Ļ���֪ʶ��

���û�ѧ��Ӧԭ���о�NH3�����ʾ�����Ҫ���塣��ش��������⣺
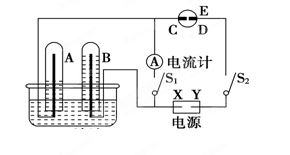
��1���������������Թ���ȼ�ϵ�أ����ط�Ӧԭ��Ϊ4NH3��3O2=2N2��6H2O����������ҺӦ���� ������ԡ������ԡ����ԡ����������ĵ缫��ӦʽΪ ��
��2��25��ʱ����amol��L��1�İ�ˮ��0.1mol��L��1������������ϡ�
�ٵ���Һ������Ũ�ȹ�ϵ����c(NH4+)>c(Cl-)��ʱ����Ӧ���������Ϊ ��
A������㣮��ˮʣ�� B����ˮ������ǡ����ȫ��Ӧ C���������
�ڵ���Һ��c(NH4+)=c(Cl-)��ʱ���ú���a���Ĵ���ʽ��ʾNH3��H2O�ĵ���ƽ�ⳣ��Kb=______________.
��3����0.5L�����ܱ������У�һ������N2��H2���з�Ӧ��N2(g)��3H2(g) 2NH3(g) ?H=bkJ/mol���仯ѧƽ�ⳣ��K���¶ȵĹ�ϵ���£�
2NH3(g) ?H=bkJ/mol���仯ѧƽ�ⳣ��K���¶ȵĹ�ϵ���£�
| �¶�/�� | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
��д���÷�Ӧ�Ļ�ѧƽ�ⳣ���ı���ʽ��__________��b________������ڡ���С�ڡ����ڡ���0
��400��ʱ�����ijʱ�̰��������������������ʵ����ֱ�Ϊ3mol��2mol��1molʱ����ʱ�̸÷�Ӧ��v����N2��_________������ڡ���С�ڡ����ڡ���v����N2��.
��4����֪����4NH3(g)��3O2(g)=2N2(g)��6H2O(g) ?H="-1266.8KJ/mol" ����N2(g)��O2(g)=2NO(g) ?H=+180.5KJ/mol��д�������´��������Ȼ�ѧ����ʽ�� ��
 O2��g����H2 O��g�� ��H����241.8kJ��mol��1
O2��g����H2 O��g�� ��H����241.8kJ��mol��1 2NO��g�� ��H
2NO��g�� ��H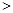 0����1.0 mol������0.80 mol N2��0.20 mol O2��1300oCʱ��1.0 L�ܱ������ھ���5s��Ӧ�ﵽƽ�⣬���NOΪ8.0��10��4 mol��
0����1.0 mol������0.80 mol N2��0.20 mol O2��1300oCʱ��1.0 L�ܱ������ھ���5s��Ӧ�ﵽƽ�⣬���NOΪ8.0��10��4 mol�� 2CO2��g����N2��g�� �У�NO��Ũ��
2CO2��g����N2��g�� �У�NO��Ũ��
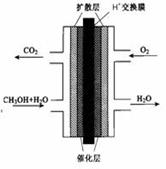
 2PbSO4��2H2O����ش��������⣨�������⡢����������ԭ����
2PbSO4��2H2O����ش��������⣨�������⡢����������ԭ���� 
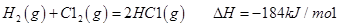
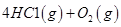
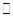
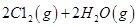

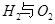 ��Ӧ������̬ˮ���Ȼ�ѧ����ʽ__________________________
��Ӧ������̬ˮ���Ȼ�ѧ����ʽ__________________________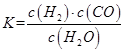
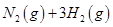
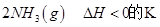 =0��5����400��ʱ����0��5L�ķ�Ӧ�����н��кϳɰ���Ӧ��һ��ʱ����N2��H2��NH3�����ʵ����ֱ�Ϊ2mol��1mol��2mol�����ʱ��Ӧ
=0��5����400��ʱ����0��5L�ķ�Ӧ�����н��кϳɰ���Ӧ��һ��ʱ����N2��H2��NH3�����ʵ����ֱ�Ϊ2mol��1mol��2mol�����ʱ��Ӧ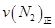 ____________
____________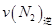 �������������������ȷ������
�������������������ȷ������
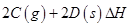 ���仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���
���仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���
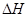 ___________0�������������
___________0������������� B��������ѹǿ���ֲ���
B��������ѹǿ���ֲ���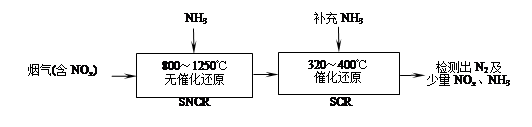
 2CO2��N2�ܹ��Է����У���÷�Ӧ�Ħ�H 0���������������
2CO2��N2�ܹ��Է����У���÷�Ӧ�Ħ�H 0���������������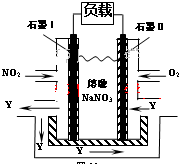
 2SO3��g�� ��H =" a" kJ·mol��1����Ӧ���̵������仯��ͼ��ʾ����֪1mol SO2��g����ȫת��Ϊ1mol SO3��g������99 kJ����ش�
2SO3��g�� ��H =" a" kJ·mol��1����Ӧ���̵������仯��ͼ��ʾ����֪1mol SO2��g����ȫת��Ϊ1mol SO3��g������99 kJ����ش�