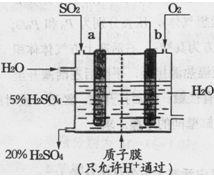
题目内容
碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用。
(1)真空碳热还原—氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
①2Al2O3(s)+2AlCl3(g)+6C(s) = 6AlCl(g)+6CO(g) ΔH=a kJ·mol-1
②3AlCl(g) = 2Al(l)+AlCl3(g) ΔH=b kJ·mol-1
反应:Al2O3(s)+3C(s)=2Al(l)+3CO(g)的ΔH = kJ·mol-1 (用含a、b的代数式表示);
(2)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)  N2(g)+CO2(g) ΔH ="Q" kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) ΔH ="Q" kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 时间/min 浓度/mol/L | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
①0~10 min内,NO的平均反应速率v(NO)= ,T1℃时,该反应的平衡常数= 。
②30 min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母编号)。
A.通入一定量的NO B.加入一定量的活性炭
C.加入合适的催化剂 D.适当缩小容器的体积
③在恒容条件下,能判断该反应一定达到化学平衡状态的依据是 (填选项编号)。
A.单位时间内生成2 n mol NO(g)的同时消耗n mol CO2(g)
B.反应体系的温度不再发生改变
C.混合气体的密度不再发生改变
D 反应体系的压强不再发生改变
(1)0.5a+b;(2)①0.032mol/( L·min) ; 0.25;②A D;③B C
解析试题分析:(1)①÷2+②。整理得Al2O3(s)+3C(s)=2Al(l)+3CO(g)的ΔH =(0.5a+b)kJ/mol (2)①0~10 min内,NO的平均反应速率v(NO)=ΔC/Δt=(1.00-0.68)mol/L÷10min=0.032mol/( L·min).T1℃时,当反应达到平衡时,化学平衡常数 .②30 min后改变了一个条件,使化学平衡发生移动,当达到新的平衡后,各种物质的浓度都增大,由于
.②30 min后改变了一个条件,使化学平衡发生移动,当达到新的平衡后,各种物质的浓度都增大,由于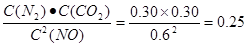 ,所以温度不变。A.通入一定量的NO 。会使反应物的浓度增大,化学平衡正向移动,由于该反应是反应前后气体体积相等的反应,所以反应物的转化率不变。最终达到平衡时各物质浓度增加的浓度比例相等。正确。B.加入一定量的活性炭,活性炭是固体,改变用量对平衡无影响。错误。C.加入合适的催化剂,只能加快反应速率,缩短达到平衡所需要的水解,化学平衡不发生移动。错误。D.适当缩小容器的体积。因为该反应是反应前后气体体积相等的反应,所以缩小容器的容积,平衡不会发生移动,单位体积内各种物质的浓度都增大。即反应物、生成物的浓度都增大。增大的比例不变。正确。③在恒容条件下,A.无论反应是否达到平衡,在任何时刻都存在单位时间内生成2 n mol NO(g)的同时消耗n mol CO2(g),所以不能作为判断反应是否达到平衡的标志。错误。B.该反应体系伴随着热效应,如果反应未达到平衡,则体系的温度必然发生变化,若不再发生改变,则必然已经达到平衡状态。正确。C,如果反应未达到平衡状态,就会有固体C的消耗或生成,气体的密度就会增大或减小。因此气体的密度不变,则反应达到了平衡状态。正确。D 由于该反应是个反应前后气体体积相等的反应,所以在容积固定的密闭容器中,在任何时刻都存在着反应体系的压强不变。因此反应体系的压强不变不能作为判断平衡是否达到的标志。错误。
,所以温度不变。A.通入一定量的NO 。会使反应物的浓度增大,化学平衡正向移动,由于该反应是反应前后气体体积相等的反应,所以反应物的转化率不变。最终达到平衡时各物质浓度增加的浓度比例相等。正确。B.加入一定量的活性炭,活性炭是固体,改变用量对平衡无影响。错误。C.加入合适的催化剂,只能加快反应速率,缩短达到平衡所需要的水解,化学平衡不发生移动。错误。D.适当缩小容器的体积。因为该反应是反应前后气体体积相等的反应,所以缩小容器的容积,平衡不会发生移动,单位体积内各种物质的浓度都增大。即反应物、生成物的浓度都增大。增大的比例不变。正确。③在恒容条件下,A.无论反应是否达到平衡,在任何时刻都存在单位时间内生成2 n mol NO(g)的同时消耗n mol CO2(g),所以不能作为判断反应是否达到平衡的标志。错误。B.该反应体系伴随着热效应,如果反应未达到平衡,则体系的温度必然发生变化,若不再发生改变,则必然已经达到平衡状态。正确。C,如果反应未达到平衡状态,就会有固体C的消耗或生成,气体的密度就会增大或减小。因此气体的密度不变,则反应达到了平衡状态。正确。D 由于该反应是个反应前后气体体积相等的反应,所以在容积固定的密闭容器中,在任何时刻都存在着反应体系的压强不变。因此反应体系的压强不变不能作为判断平衡是否达到的标志。错误。
考点:考查反应热、化学反应速率、化学平衡常数的计算及平衡状态的判断和影响因素的知识。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
①已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH1=+489.0 kJ·mol-1
C(石墨)+CO2(g)=2CO(g) ΔH2=+172.5 kJ·mol-1
则CO还原Fe2O3的热化学方程式为___________________________
②利用燃烧反应可设计成CO/O2燃料电池(以KOH溶液为电解液),写出该电池的负极反应式___________________________________________
(2)某实验将CO2和H2充入一定体积的密闭容器中,在两种不同条件下反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1
测得CH3OH的物质的量随时间变化如上图所示,回答问题:
①下列措施中能使n(CH3OH)/n(CO2)增大的是________。
| A.升高温度 | B.充入He(g)使体系压强增大 |
| C.将H2O(g)从体系中分离 | D.再充入1 mol CO2和3 mol H2 |
③一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡。
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1 mol CO2、3 mol H2 | a mol CO2、b mol H2、c mol CH3OH(g)、c mol H2O(g) |
若甲中平衡后气体的压强为开始时的
 ,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为________。
,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为________。(3)用0.10 mol·L-1盐酸分别滴定20.00 mL 0.10 mol·L-1的NaOH溶液和20.00 mL 0.10 mol·L-1氨水所得的滴定曲线如下:

请指出盐酸滴定氨水的曲线为________(填“A”或“B”),请写出曲线a点所对应的溶液中各离子浓度由大到小的排列顺序________。
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。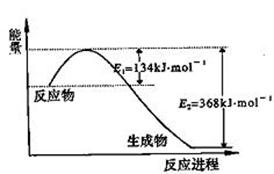
(1)上图是1 mol NO2气体和1 mol CO气体反应生成CO2气体和NO气体过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: ;
已知:N2 (g)+2NO2 (g)  4NO(g) △H=+292.3kJ·mol—1,
4NO(g) △H=+292.3kJ·mol—1,
则反应: 2NO(g)+2CO(g)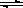 N2(g)+2CO2(g) 的△H= ;
N2(g)+2CO2(g) 的△H= ;
(2)一定温度下,在体积为2L的恒容密闭容器中充入20 mol NO2和5 mol O2发生反应: 4NO2(g)+O2(g) 2N2O5(g);已知体系中n(NO2)随时间变化如下表:
2N2O5(g);已知体系中n(NO2)随时间变化如下表:
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
①写出该反应的平衡常数表达式:K= ,已知:K3000C>K3500C,则该反应是 反应(填“放热”或“吸热”);
②反应达到平衡后,NO2的转化率为 ,若要增大NO2的转化率,可采取的措施有
A.降低温度
B.充入氦气,使体系压强增大
C.再充入NO2
D.再充入4 mol NO2和1 mol O2
③图中表示N2O5的浓度的变化曲线是 ,用O2表示从0~500s内该反应的平均速率v= 。
 CH3OH(g) ΔH <0。
CH3OH(g) ΔH <0。
 O2(g)=H2 O(g) △H=-241.8kJ·mol-1
O2(g)=H2 O(g) △H=-241.8kJ·mol-1 2NO(g) △H
2NO(g) △H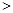 0,若1.0 mol空气含0.80 mol N2和0.20 mol O2,1300oC时在1.0 L密闭容器内经过5s反应达到平衡,测得NO为8.0×10-4 mol。
0,若1.0 mol空气含0.80 mol N2和0.20 mol O2,1300oC时在1.0 L密闭容器内经过5s反应达到平衡,测得NO为8.0×10-4 mol。 2CO2(g)+N2(g) 中,NO的浓度
2CO2(g)+N2(g) 中,NO的浓度
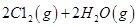

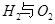 反应生成气态水的热化学方程式__________________________
反应生成气态水的热化学方程式__________________________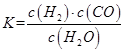
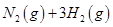
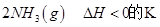 =0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应
=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应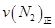 ____________
____________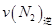 (填:>、<、=、不能确定);
(填:>、<、=、不能确定);
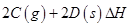 ,其化学平衡常数K与温度T的关系如下表:
,其化学平衡常数K与温度T的关系如下表:
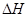 ___________0(填“>”或“<”)
___________0(填“>”或“<”) B.容器内压强保持不变
B.容器内压强保持不变 2SO3(g) △H="-197" kj/mol。开始时在10 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出197kJ的热量,该温度下的平衡常数K= ,升高温度K将 (填“增大、减小或不变”)。
2SO3(g) △H="-197" kj/mol。开始时在10 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出197kJ的热量,该温度下的平衡常数K= ,升高温度K将 (填“增大、减小或不变”)。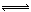 2SO3(g),化学兴趣小组的同学探究了其他条件不变时,改变某一条件时对上述反应的影响,并根据实验数据作出了下列关系图。下列判断中正确的是 (填字母)。
2SO3(g),化学兴趣小组的同学探究了其他条件不变时,改变某一条件时对上述反应的影响,并根据实验数据作出了下列关系图。下列判断中正确的是 (填字母)。