题目内容
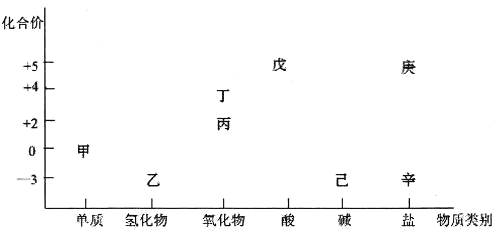
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A. 使酚酞变红色的溶液中:Na+、Al3+、SO42﹣、Cl﹣
B. ![]() 的溶液中:NH4+、Ca2+、Cl﹣、NO3﹣
的溶液中:NH4+、Ca2+、Cl﹣、NO3﹣
C. ![]() 的溶液:NH4+、Cu2+、NO3-、Cl-
的溶液:NH4+、Cu2+、NO3-、Cl-
D. 水电离的c(H+)=1×10﹣13 mol·L﹣1的溶液中:K+、Na+、AlO2﹣、CO32﹣
【答案】B
【解析】
A.使酚酞变红色的溶液,显碱性,不能大量存在Al3+,故A错误; B.![]() = c(OH-)=1×10-13molL-1的溶液,显酸性,该组离子之间不反应,可大量共存,故B正确C.
= c(OH-)=1×10-13molL-1的溶液,显酸性,该组离子之间不反应,可大量共存,故B正确C.![]() =1×1012的溶液,显碱性,不能大量存在NH4+,故C错误;D.水电离的c(H+)=1×10-13molL-1的溶液,为酸或碱溶液,酸溶液中不能大量存在AlO2-、CO32-,故D错误;故选B。
=1×1012的溶液,显碱性,不能大量存在NH4+,故C错误;D.水电离的c(H+)=1×10-13molL-1的溶液,为酸或碱溶液,酸溶液中不能大量存在AlO2-、CO32-,故D错误;故选B。

【题目】(1)反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)在一容积可变的密闭容器中进行,试回答:
Fe3O4(s)+4H2(g)在一容积可变的密闭容器中进行,试回答:
①增加Fe的量,其反应速率____(填“增大”、“不变”或“减小”,下同)。
②将容器的体积缩小一半,其反应速率____。
③保持体积不变,充入He,其反应速率____。
④保持压强不变,充入He,其反应速率_____。
(2)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g)+4NH3(g)![]() 5N2(g)+6H2O(g)。
5N2(g)+6H2O(g)。
①能说明该反应已达到平衡状态的标志是____(填字母序号)
a.反应速率5v(NH3)=4v(N2)
b.单位时间里每生成5mol N2,同时生成4mol NH3
c.容器内N2的物质的量分数不再随时间而发生变化
d.容器内n(NO):n(NH3):n(N2):n(H2O)=6:4:5:6
②某次实验中测得容器内NO及N2的物质的量随时间变化如图所示,图中v(正)与v(逆)相等的点为_____(选填字母)。

(3)298K时,若已知生成标准状况下2.24LNH3时放出热量为4.62kJ。写出合成氨反应的热化学方程式____。
(4)一定条件下,在2L密闭容器内,反应2NO2(g)=N2O4(g)△H=-180kJ·mol-1,n(NO2)随时间变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
用NO2表示0~2s内该反应的平均速度____。在第5s时,NO2的转化率为____。根据上表可以看出,随着反应进行,反应速率逐渐减小,其原因是____。