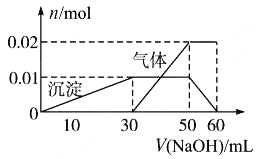
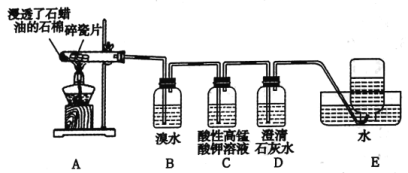
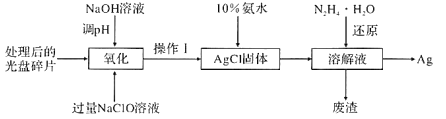
题目内容
【题目】(1)一种铜金合金晶体具有面心立方体结构,在晶胞中Cu原子处于面心,Au原子处于顶点,则该合金中Cu原子与Au原子数量之比为________。
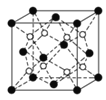
(2)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2(如下图)的结构相似,该晶体储氢后的化学式应为________。
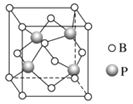
(3)立方BP(磷化硼)的晶胞结构如下图所示,晶胞中含B原子数目为________。
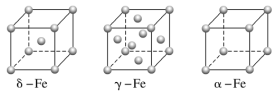
(4)铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为________,δ、α两种晶胞中铁原子的配位数之比为________。
【答案】3∶1 H8AuCu3 4 4 4∶3
【解析】
利用均摊法解题。
(1)一种铜金合金晶体具有面心立方体结构,在晶胞中Cu原子处于面心,Cu原子数为6×![]() =3个,Au原子处于顶点,Au原子数8×
=3个,Au原子处于顶点,Au原子数8×![]() =1个,则该合金中Cu原子与Au原子数量之比为3:1。故答案为:3∶1;
=1个,则该合金中Cu原子与Au原子数量之比为3:1。故答案为:3∶1;
(2)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中,一个晶胞含8个四面体空隙,即含有8个H原子,由(1)得晶胞中含1个Au原子,3个Cu原子,该晶体储氢后的化学式应为H8AuCu3。故答案为:H8AuCu3;
(3)由立方BP(磷化硼)的晶胞结构图,顶点:B原子数8×![]() =1个,面心:B原子数为6×
=1个,面心:B原子数为6×![]() =3个,晶胞中含B原子数目为4。故答案为:4;
=3个,晶胞中含B原子数目为4。故答案为:4;
(4)铁有δ、γ、α三种同素异形体,γ晶体晶胞中,顶点:Fe原子数8×![]() =1个,面心:Fe原子数为6×
=1个,面心:Fe原子数为6×![]() =3个,晶胞中含Fe原子数目为4;δ晶胞中铁原子的配位数为8,α晶胞中铁原子的配位数6,δ、α两种晶胞中铁原子的配位数之比为8:6=4∶3。故答案为:4;4∶3。
=3个,晶胞中含Fe原子数目为4;δ晶胞中铁原子的配位数为8,α晶胞中铁原子的配位数6,δ、α两种晶胞中铁原子的配位数之比为8:6=4∶3。故答案为:4;4∶3。

【题目】据公安部2019年12月统计,2019年全国机动车保有量已达3.5亿。汽车尾气排放的碳氢化合物、氮氧化物及一氧化碳是许多城市大气污染的主要污染物。氮的化合物合成、应用及氮的固定一直是科学研究的热点。
I: (1)以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);ΔH1=-159.47 kJ·mol1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g);ΔH2=a kJ·mol1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);ΔH3=-86.98 kJ·mol1
则a为______。
(2)尿素可用于湿法烟气脱氮工艺,其反应原理为:NO+NO2+H2O=2HNO2;2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O。
①当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳。若烟气中V(NO)∶V(NO2)=5∶1时,可通入一定量的空气,同温同压下,V(空气)∶V(NO)=______(空气中氧气的体积含量大约为20%)。
②如图1表示尿素含量对脱氮效率的影响,从经济因素上考虑,一般选择尿素浓度约为______%。

(3)图2表示使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造出既能提供能量,同时又能实现氮固定的新型燃料电池。请写出该电池的正极反应式______,生产中可分离出的物质A的化学式为______。
II: 向容积为2L的密闭容器中加入活性炭![]() 足量
足量![]() 和NO,发生反应:
和NO,发生反应:![]()
![]()
![]() △H<0,NO和
△H<0,NO和![]() 的物质的量变化如下表所示。
的物质的量变化如下表所示。
物质的量 |
| T2/0C | |||||
0 |
|
|
|
|
|
| |
NO |
|
|
|
|
|
|
|
| 0 |
|
|
|
|
|
|
(1)T1℃温度下,反应进行了![]() ,用二氧化碳表示该反应的平均反应速率
,用二氧化碳表示该反应的平均反应速率![]() ______。已知:气体分压
______。已知:气体分压![]() 气体总压
气体总压![]() 体积分数。
体积分数。![]() 时用平衡分压代替平衡浓度计算平衡常数
时用平衡分压代替平衡浓度计算平衡常数![]() ______。
______。
![]() 第
第![]() 后,温度调整到
后,温度调整到![]() ,数据变化如上表所示,则
,数据变化如上表所示,则![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
(3)若30min时,保持![]() 不变,向该容器中再加入该四种反应混合物各
不变,向该容器中再加入该四种反应混合物各![]() ,则此时反应______移动
,则此时反应______移动![]() 填“正向”“逆向”或“不”
填“正向”“逆向”或“不”![]() 。
。
【题目】(1)某学生用0.1500 mol/L NaOH溶液测定某未知浓度的盐酸溶液,其操作可分解为如下几步:
A.用蒸馏水洗净滴定管
B.用待测定的溶液润洗酸式滴定管
C.用酸式滴定管取稀盐酸25.00 mL,注入锥形瓶中,加入酚酞
D.另取锥形瓶,再重复操作2~3次
E.检查滴定管是否漏水
F.取下碱式滴定管用标准NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2~3 cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
完成以下填空:
(1)滴定时正确操作的顺序是(用序号字母填写):____→ → F → → → → D。
(2)操作F中应该选择图中滴定管_____(填标号)。

(3)滴定时边滴边摇动锥形瓶,眼睛应注意观察_____。
(4)滴定结果如表所示:
滴定次数 | 待测液体积/mL | 标准溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 0.60 | 20.60 |
3 | 25.00 | 0.20 | 20.19 |
计算该盐酸的物质的量浓度为_____(精确至0.0001)。
(5)下列操作会导致测定结果偏高的是_____。
A.碱式滴定管在装液前未用标准NaOH溶液润洗
B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出
C.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
(6)氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①可将2mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成 CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20mL l.0×l0﹣4 mol/L的KMnO4溶液。
Ⅰ、写出用KMn04滴定H2C2O4的离子方程式_____________________。
Ⅱ、判断滴定终点的方法是________________________。
Ⅲ、计算:血液中含钙离子的浓度为_____mol/L。