题目内容
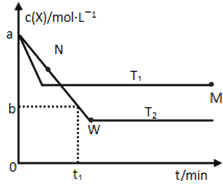
【题目】C(s)+2H2(g)![]() CH4(g) ΔH。在1 L密闭容器中投入1mol碳,并充入2mol H2,测得相关数据如图所示。
CH4(g) ΔH。在1 L密闭容器中投入1mol碳,并充入2mol H2,测得相关数据如图所示。
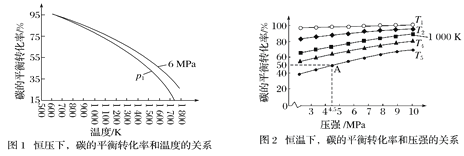
(已知:可用平衡分压代替平衡浓度算出平衡常数Kp,分压=总压×物质的量分数 )下列有关说法错误的
A.ΔH<0B.p1<6MPaC.T1<1 000 KD.A点的平衡常数Kp=![]()
【答案】D
【解析】
A.有图像1,在等压线下,升高温度,碳的平衡转化率降低,说明平衡逆向进行,逆反应是吸热反应,正反应是放热反应,ΔH<0,故A正确;
B.有图像1,向横坐标作垂线,即等温线,该反应正向是体积缩小的反应,碳的转化率越高 ,说明平衡正向进行,压强越大,即p1<6Mpa,故B正确;
C. 有选项A可知,正反应是放热反应,向横坐标作垂线,即是等压线,保持压强不变,升高温度,平衡逆向进行,碳的转化率降低,故T1<1 000 K,故C正确;
D.起始C和H2的物质的量分别为1mol和2mol,在A点碳的平衡转化率为50%,
可逆反应C(s)+2H2(g)CH4(g)
开始(mol)1 2 0
反应(mol)0.5 10.5
平衡(mol)0.5 10.5
平衡时P(H2)=1mol÷(0.5mol+1mol+0.5mol)×4.5MPa、P(CH4)=0.5mol÷(0.5mol+1mol+0.5mol)×4.5MPa,该反应的平衡常数Kp= P(CH4)÷P2(H2)= (0.5mol÷(0.5mol+1mol+0.5mol)×4.5MPa)÷(1mol÷(0.5mol+1mol+0.5mol)×4.5Mpa)2=2/9,故D错误;
故选:D.

 特高级教师点拨系列答案
特高级教师点拨系列答案【题目】A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下:(NA为阿伏加德罗常数的值),请用化学用语回答下列问题:
元素 | 相关信息 |
A | 基态原子的价电子排布式为nSnnPn |
B | 元素原子的核外p电子数比s电子数少1个 |
C | 最外层电子数是电子层数的3倍 |
D | 简单离子是第三周期元素中离子半径最小的 |
E | 价电子层中的未成对电子数为4 |
(1)写出D元素在周期表的位置______,基态E2+价电子的排布图为_______,B元素能量最高的电子其轨道呈_______形。
(2)A与C形成的最高价化合物,中心原子轨道杂化类型为___________。
(3)A、B、C三种基态原子的第一电离能由大到小的顺序为_____________,B、C、D简单离子的半径由大到小的顺序为_________。
(4)写出C的核外有18个电子的氢化物的电子式________。
(5)E可用做某些反应的催化剂,CO易导致E失去催化活性:E+5CO = E(CO)5,E(CO)5熔点为-20℃,沸点为103℃,易溶于乙醚,其晶体类型为___________。
(6)已知沸点:B2H4>A2H6 ,主要原因为____________________。
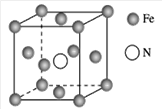
(7)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为________;设晶胞边长为a cm,该晶体的密度为________ g·cm-3(用含a和NA的式子表示)。