题目内容
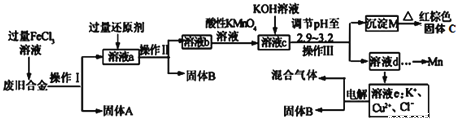
【题目】下表列出了①~⑦七种元素在周期表中的位置。

请按要求回答:
(1)七种元素中,原子半径最大的是(填元素符号)_________。
(2)③与⑦的气态氢化物中,稳定性较强的是(填化学式)_________。
(3)元素⑥的最高价氧化物对应的水化物是(填化学式)_________。
(4)由①、②、③三种元素组成的离子化合物是_________,检验该化合物中阳离子的方法是_________。
(5)含有上述元素的物质间存在以下转化。
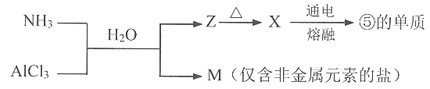
M所含的化学键类型是_________。X生成⑤的单质的化学方程式是_________。
【答案】NaH2OH2SiO3NH4NO3取少量该化合物于试管中,加入NaOH浓溶液,加热,将湿润的红色石蕊试纸放在试管口,若试纸变蓝,则证明有铵离子存在。离子键和极性共价键2Al2O3(熔融)![]() 4Al+3O2↑
4Al+3O2↑
【解析】
根据元素周期表知,①是H元素、②是N元素、③是O元素、④是Na元素、⑤是Al元素、⑥是Si元素、⑦是S元素,利用元素、单质、化合物的性质及元素周期律来分析解答。
根据元素周期表知,①是H元素、②是N元素、③是O元素、④是Na元素、⑤是Al元素、⑥是Si元素、⑦是S元素。(1)同周期从左到右,原子半径依次减小,同主族从上到下,原子半径依次增大,故这七种元素中,原子半径最大的是Na;(3)同主族从上到下,非金属性减弱,气态氢化物的稳定性减弱,故③与⑦的气态氢化物中,稳定性最强的是H2O;(3)元素⑥为硅元素,其最高价氧化物对应的水化物是H2SiO3;(4)由①、②、③三种元素组成的离子化合物是NH4NO3,检验该化合物中阳离子铵根离子的方法是取少量该化合物于试管中,加入NaOH浓溶液,加热,将湿润的红色石蕊试纸放在试管口,若试纸变蓝,则证明有铵离子存在;(5)氯化铝溶液中通入氨气反应生成氢氧化铝和氯化铵,根据M为仅含非金属元素的盐可知M为氯化铵,氯化铵由铵根离子和氯离子构成,铵根离子中氮原子与氢原子形成共价键,故M所含的化学键类型是离子键和极性共价键;Z为氢氧化铝,加热氢氧化铝生成氧化铝和水,则X为氧化铝,电解熔融氧化铝得到⑤的单质铝,反应的化学方程式为2Al2O3(熔融)![]() 4Al+3O2↑。
4Al+3O2↑。