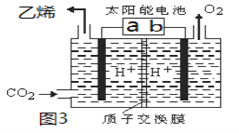
题目内容
【题目】某研究性学习小组对某废旧合金(含有Cu、Fe、Si三种成分)进行分离、回收。其工业流程如下:
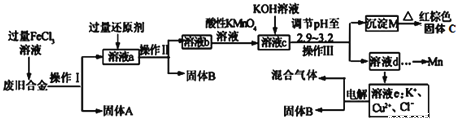
已知:298K时,Ksp[Cu(OH)2]=2.0×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=1.9×10-13,
根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ一定都不含有的操作是________。
A.过滤B.洗涤C.干燥D.蒸馏
(2)过量的还原剂应是__________________,溶液a中发生的反应的离子方程式为________________________________。
(3)若用xmol/LKMnO4溶液处理溶液b,当恰好将溶液中的阳离子完全氧化时消耗KMnO4溶液ymL,则最后所得红棕色固体C的质量为________g(用含x、y的代数式表示)。
(4)将溶液c调节pH至2.9-3.2的目的是______________________________。
(5)常温下,取0.2mol/L的CuCl2溶液,若要使Cu2+开始沉淀,应调节pH至___________。
(6)用惰性电极电解溶液e制取固体B,所发生的化学反应方程式为___________________________。
【答案】 D Cu或铜 2Fe3++Cu=2Fe2++Cu2+ 0.4xy 保证Fe Fe3+沉淀完全而其他金属阳离子不沉淀 4.5 CuCl2![]() Cu+ Cl2↑
Cu+ Cl2↑
【解析】(1)操作Ⅰ、Ⅱ、Ⅲ都是将不溶固体与液体分离,所以都有过滤、洗涤、干燥的操作,则不可能存在蒸馏操作,蒸馏是分离互溶液体的操作,答案选D;(2)过量的氯化铁溶液与合金中的Cu、Fe反应生成氯化亚铁和氯化铜,同时溶液中还存在过量的氯化铁,根据流程图可知固体B可由溶液e得到,所以B为Cu,则过量的还原剂是铜或Cu;溶液a中发生的离子方程式是2Fe3++Cu=2Fe2++Cu2+;(3)溶液b为氯化亚铁和氯化铜的混合液,若用x mol/L KMnO4溶液处理溶液b,则高锰酸钾与亚铁离子发生氧化还原反应,亚铁离子被氧化为铁离子,高锰酸根离子被还原为锰离子,当恰好将溶液中的阳离子完全氧化时消耗KMnO4溶液ymL,根据得失电子守恒,则亚铁离子的物质的量是xy×10-3×5mol,生成的红棕色固体为Fe2O3,则该固体的质量是xy×10-3×![]() ×160g/mol=0.4xyg;(4)根据沉淀的溶度积的数值,氢氧化铁的溶度积最小,所以溶液pH调节至2.9-3.2的目的是保证Fe3+沉淀完全而其他金属阳离子不沉淀;(5)常温下,取0.2mol/L的CuCl2溶液,则铜离子的浓度是0.2mol/L,若要使Cu2+开始沉淀,则c(Cu2+)c2 (OH-)= Ksp[Cu(OH)2],所以c(OH-)=10-9.5mol/L,则pH=4.5,所以将溶液调节至4.5时铜离子开始沉淀;(6)溶液e中含有氯化铜,钾离子的放电能力较铜离子弱,则用惰性电极电解氯化铜时,电解的实质是电解溶质氯化铜,所以反应方程式是CuCl2
×160g/mol=0.4xyg;(4)根据沉淀的溶度积的数值,氢氧化铁的溶度积最小,所以溶液pH调节至2.9-3.2的目的是保证Fe3+沉淀完全而其他金属阳离子不沉淀;(5)常温下,取0.2mol/L的CuCl2溶液,则铜离子的浓度是0.2mol/L,若要使Cu2+开始沉淀,则c(Cu2+)c2 (OH-)= Ksp[Cu(OH)2],所以c(OH-)=10-9.5mol/L,则pH=4.5,所以将溶液调节至4.5时铜离子开始沉淀;(6)溶液e中含有氯化铜,钾离子的放电能力较铜离子弱,则用惰性电极电解氯化铜时,电解的实质是电解溶质氯化铜,所以反应方程式是CuCl2![]() Cu+Cl2↑。
Cu+Cl2↑。
点晴:本题考查了实验方案的设计,设计实验基本操作,物质的分离与除杂,离子方程式的书写,沉淀溶解平衡及电解原理,题目较难,要考虑整个流程,从实验目的出发围绕问题根据化学原理一步步解答。本题的主要流程是这样的:含有Cu、Fe、Si废旧合金中的铁与铜与过量的氯化铁溶液发生氧化还反应,得到固体硅和含氯化铜、氯化亚铁和氯化铁的混合溶液a,加入过量的还原剂铜粉,得到时氯化亚铁和氯化铜的混合溶液b,然后向溶液中加入酸性高锰酸钾将亚铁离子氧化成铁离子,得到含锰离子、铁离子和铜离子的混合溶液中滴加氢氧化钾调节溶液的pH使铁离子完全沉淀,然后过滤得到氢氧化铁固体,灼烧得到氧化铁,溶液e电解阳氯离子放电得到氯气,阴极铜离子放电得到单质铜。

【题目】已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表:
醋酸 | 碳酸 | 亚硫酸 |
Ka=1.75×10﹣5 | Ka1=4.30×10﹣7 Ka2=5.61×10﹣11 | Ka1=1.54×10﹣2 Ka2=1.02×10﹣7 |
(1)写出碳酸的第一步电离平衡常数表达式:Ka1=__.
(2)在相同条件下,试比较H2CO3、HCO3﹣和HSO3﹣的酸性强弱:__>__>__.
(3)如图表示常温时稀释醋酸、碳酸两种酸的稀溶液时,溶液pH随水量的变化图象中:

①曲线I表示的酸是__(填化学式).
②A、B、C三点中,水的电离程度最大的是__(填字母).
(4)下列事实不能说明醋酸是弱酸的是_______
①当温度低于16.6℃时醋酸可凝结成冰一样晶体
②0.1mol/L的醋酸钠溶液的pH约为9
③等体积等物质的量浓度的硫酸比醋酸消耗氢氧化钠多
④0.1mol/L的醋酸的pH约为4.8
⑤pH都等于4且等体积的醋酸和盐酸,与等浓度NaOH溶液充分反应时,醋酸消耗碱液多
⑥同物质的量浓度的醋酸和盐酸加水稀释至pH相同时,醋酸加入的水多
【题目】一定温度下,在3个体积均为1.0L的恒容密闭容器中反应2H2 (g) +CO (g) ![]() CH3OH (g)达到平衡。下列说法正确的是
CH3OH (g)达到平衡。下列说法正确的是
容器 | 温度/K | 物质的起始浓度/mol.L-l | 物质的平衡浓度/mol.L-1 | ||
c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
I | 400 | 0.20 | 0.10 | 0 | 0.080 |
II | 400 | 0.40 | 0.20 | 0 | |
III | 500 | 0 | 0 | 0.10 | 0.025 |
A. 该反应的逆反应放热
B. 达到平衡时,容器I中反应物转化率比容器II中的大
C. 达到平衡时,容器II中c(H2)大于容器III中c(H2)的两倍
D. 达到平衡时,容器III中的正反应速率比容器I中的大
【题目】某小组同学通过“FeSO4被浓HNO3氧化”的实验,验证Fe2+的还原性。
实验一:验证Fe2+的还原性
实验操作 | 预期现象 | 实验现象 |
向盛有2 mL FeSO4溶液的试管中,滴入几滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液变为黄色 | 试管中产生红棕色气体,溶液变为深棕色 |
(1)红棕色气体是_______。
(2)实验现象与预期不符,继续进行实验。
取深棕色溶液于试管中,滴加KSCN溶液,溶液变为红色,该现象说明_______。
实验二:探究溶液变为深棕色的原因
(资料与猜想)
查阅资料后猜想,可能是生成的NO2或NO与溶液中的Fe2+或Fe3+反应,而使溶液变为深棕色。
(实验与探究)
用下图所示装置进行实验(气密性已检验,尾气处理已略去)

i. 关闭c,打开a和b,通入N2,一段时间后关闭a;
ii. 向甲中加入适量浓HNO3,一段时间后丙中溶液变为深棕色,丁中溶液无明显变化;
iii. 关闭b、打开c,更换丙、丁中的溶液(试剂不变);
iv. 继续向甲中加入浓HNO3,一段时间后观察到了与ii相同的实验现象。
(1)通入N2的目的是________。
(2)铜与浓硝酸反应的化学方程式是________。
(3)装置乙的作用是________。
(4)实验结论是________。
(反思与改进)
实验三:验证Fe2+的还原性
该小组同学依据实验二的结论改进了实验一,观察到了预期现象,其实验操作是________。