题目内容
【题目】取两份铝片,第一份与足量稀硫酸反应,第二份与足量NaOH溶液反应,同温同压下放出相同体积的气体,则两份铝片的质量之比为 ( )
A.2:3B.1:1C.3:2D.1:3
【答案】B
【解析】
第一份发生反应:2Al+3H2SO4=Al2(SO4)3+3H2↑,第二份发生反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,由于硫酸、氢氧化钠足量,Al完全反应,同温同压下,两反应中放出相同体积的氢气,由方程式可知消耗Al的质量相等,即两份铝片的质量之比为1:1,故B正确;
故选B。

 阅读快车系列答案
阅读快车系列答案【题目】草酸(H2C2O4)是一种重要的有机化工原料.为探究草酸的性质,某化学研究性学习小组查阅了有关资料,有关物质的部分性质如下表:
物质 | 熔点/℃ | 性质 |
H2C2O4 | 189.5 | 有毒,具有腐蚀性,易溶于水,二元弱酸,比醋酸酸性强,100℃开始升华,157℃时开始分解.草酸与浓硫酸混合加热产生CO2,CO和H2O.草酸钙和草酸氢钙均为白色难溶物 |
[实验一]根据下图提供的仪器和试剂(可重复使用),设计实验证明草酸与浓硫酸混合加热产物中含有CO2和CO(部分夹持仪器和加热装置省略)。
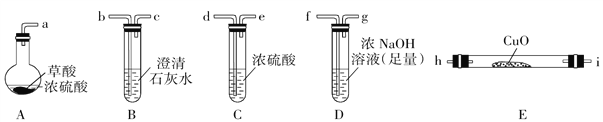
(1)仪器接口依次连接的合理顺序为a→____________________________.
(2)用上图提供的仪器和试剂做实验时,首次使用的装置B中出现白色浑浊,并不能说明草酸受热分解产物中一定有CO2,请你提出改进意见:__________________.
(3)利用改进后的装置进行实验时,要先加热______装置(填装置标号,下同)后加热______装置.
[实验二]利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.
(4)实验时,先分别量取两种溶液,然后倒入试管中,迅速振荡混匀并开始计时,通过测定溶液褪色所需的时间来判断反应的快慢.该小组设计了如下的方案:
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
浓度/ mol·L-1 | 体积/mL | 浓度/ mol·L-1 | 体积/mL | ||
1 | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
2 | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
3 | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
①已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需满足的关系为n(H2C2O4)/n(KMnO4) ≥__________.
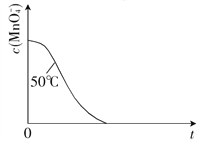
②探究温度对化学反应速率影响的实验编号是__________,探究反应物浓度对化学反应速率影响的实验编号是__________.
③已知50℃时c(MnO![]() )-t(反应时间)的变化曲线如图.若保持其他条件不变,请在图中画出25℃时c(MnO
)-t(反应时间)的变化曲线如图.若保持其他条件不变,请在图中画出25℃时c(MnO![]() )-t的变化曲线示意图并注明温度.
)-t的变化曲线示意图并注明温度.
【题目】(Ⅰ)(1)已知在448℃时,反应H2(g)+I2(g)2HI(g)ΔH<0的平衡常数K1为49,则该温度下反应2HI(g)H2(g)+I2(g)的平衡常数K2为______;反应1/2H2(g)+1/2I2(g)HI(g)的平衡常数K3为_______.
(2)在某一密闭容器中发生上述反应,改变反应的某一条件(混合气体的总物质的量不变),造成容器内压强增大,则下列说法中正确的是_____
A.容器内气体的颜色变深,混合气体的密度增大
B.平衡不发生移动
C.I2(g)的转化率增大,H2的平衡浓度变小
D.改变条件前后,速率图象如图所示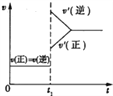
(Ⅱ)在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=______.
(2)该反应为______反应(填“吸热”或“放热”).
(3)能判断该反应达到化学平衡状态的依据是______.
A.容器中压强不变 B.混合气体中c(CO)不变
C.V(H2)正=V(H2O)逆 D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)c(H2)=c(CO)c(H2O),判断此时温度为______℃.
(5)在800℃时,发生上述反应,某时刻测得容器内各物质的浓度分别为c(CO2)=2mol/L (H2)=1.5mol/L 、 c(CO)=1mol/L 、 c(H2O)=3mol/L,则下一时刻,反应向_________填“正反应”或“逆反应”)方向进行。