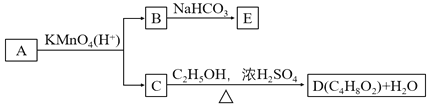
题目内容
【题目】KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。利用“KClO3氧化法”制备KIO3工艺流程如图所示:

已知:酸化反应产物有KH(IO3)2、Cl2和KCl
(1)“酸化反应”所需I2从海带中提取。经历灼烧海带,浸泡海带灰等步骤,向获得的I-溶液加入MnO2,在酸性条件下生成I2,其离子反应方程式为___。
(2)酸化产物KH(IO3)2所含化学键有___,“调pH”中发生反应的化学方程式为___。
(3)已知KIO3在水中随温度升高而增大,则浓缩结晶的具体步骤是___。
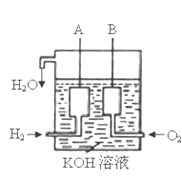
(4)KIO3也可采用“电解法”制备,装置如图所示。

①KOH与I2制备KIO3的离子反应方程式为___。
②电解时阳极的电极反应式:___;阴极的电极反应式:___。
【答案】2I-+MnO2+4H+=I2+Mn2++2H2O 离子键、共价键 KH(IO3)2+KOH=2KIO3+H2O或(HIO3+KOH=KIO3+H2O) 蒸发浓缩、冷却结晶、过滤、洗涤 3I2+6OH-=5I-+IO3-+3H2O I2-10e-+12OH-=2IO3-+6H2O 2H2O+2e-=2OH-+H2↑
【解析】
(1)I-离子在酸性条件下和MnO2发生氧化还原反应,生成锰离子、碘单质和水,离子反应为2I-+MnO2+4H+=I2+Mn2++2H2O;
(2)KH(IO3)2属于离子化合物,结构中存在离子键和共价键;调节pH时,将KH(IO3)2转化为KClO3,与碱反应可得,方程式为:KH(IO3)2+KOH=2KIO3+H2O或(HIO3+KOH=KIO3+H2O);
(3)KIO3的溶解度在水中随温度升高而增大,浓缩结晶要蒸发浓缩,冷却结晶,过滤,洗涤;
(4)①碘单质与氢氧化钾溶液发生反应生成碘化钾、碘酸钾和水,离子反应为:3I2+6OH-=5I-+IO3-+3H2O;
②由图可知,b与电源的负极相连,是阴极,阴极上水中的氢得到电子,电极反应为:2H2O+2e-=2OH-+H2↑;a与电源正极相连,为阳极,阳极上碘失去电子生成碘酸根,电极反应为:I2-10e-+12OH-=2IO3-+6H2O。

 中考解读考点精练系列答案
中考解读考点精练系列答案