题目内容
3.下列溶液中有关物质的量浓度关系正确的是( )| A. | pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)═c(OH-)+c(A-) | |
| B. | 物质的量浓度相等的CH3COONa、NaOH和Na2CO3三种溶液:pH(NaOH)>pH(CH3COONa)>pH(Na2CO3) | |
| C. | NaHCO3溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO32-) | |
| D. | 10℃时pH=12的NaOH溶液与40℃时pH=12的NaOH溶液中c(OH-)相等 |
分析 A.根据溶液的电中性原则分析;
B.氢氧化钠为强碱,其pH最大;碳酸钠的水解程度大于醋酸,则醋酸钠溶液的pH最小;
C.根据碳酸氢钠溶液中电荷守恒、物料守恒进行判断;
D.pH=12时溶液中的氢离子浓度相等,但是水的离子积不相同,则溶液中氢氧根离子浓度不相等.
解答 解:A.溶液遵循电中性原则,根据电荷守恒可得:c(H+)+c(M+)═c(OH-)+c(A-),故A正确;
B.由于氢氧化钠为强碱,其pH最大,醋酸的酸性大于碳酸,则碳酸钠的水解程度大于醋酸钠,则等浓度的三种溶液的pH大小为:pH(NaOH)>pH(Na2CO3)>pH(CH3COONa),故B错误;
C.根据碳酸氢钠溶液中的电荷守恒可得:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),根据物料守恒可得:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),二者结合可得:c(OH-)+c(CO32-)=c(H2CO3)+c(H+),整理可得:c(OH-)-c(H+)=c(H2CO3)-c(CO32-),故C正确;
D.温度升高,水的离子积增大,10℃时pH=12的NaOH溶液与40℃时pH=12的NaOH溶液中的氢离子浓度相等,由于水的离子积不同,则溶液中的c(OH-)不相等,故D错误;
故选AC.
点评 本题考查离子浓度的大小比较,题目难度中等,注意从电荷守恒、物料守恒、结合盐类的水解和弱电解质的电离程度解答该题,试题培养了学生的分析能力及灵活应用基础知识的能力.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
14.食品的主要成分大都是有机化合物.下列食品中的有机成分属于高分子化合物的是( )
| A. | 食醋中含有的醋酸 | B. | 酒中含有的酒精 | ||
| C. | 葡萄中含有的葡萄糖 | D. | 谷类中含有的淀粉 |
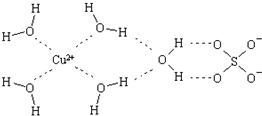 科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示.
科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示.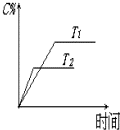 可逆反应aA(s)+bB(g)?c C(g)+d D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)如图.下列叙述一定正确的是B
可逆反应aA(s)+bB(g)?c C(g)+d D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)如图.下列叙述一定正确的是B 波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上,鲜蓝色的胆矾晶体是配制波尔多液的主要原料.胆矾CuSO4?5H2O可写成[Cu(H2O)4]SO4?H2O,其结构示意图如图:
波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上,鲜蓝色的胆矾晶体是配制波尔多液的主要原料.胆矾CuSO4?5H2O可写成[Cu(H2O)4]SO4?H2O,其结构示意图如图: ,与铜同周期的所有元素的基态原子中最外层电子数与铜原子相同的元素有K、Cr(填元素符号).
,与铜同周期的所有元素的基态原子中最外层电子数与铜原子相同的元素有K、Cr(填元素符号). 运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义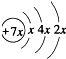 .B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
.B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题: ,这样排布遵循了泡利原理和洪特规则.
,这样排布遵循了泡利原理和洪特规则.