题目内容
【题目】Ⅰ.1871 年门捷列夫最早预言了类硅元素锗,1886 年德国化学家温克勒发现和分离了锗元素,并以其祖国的名字命名为“Ge”。锗是重要的半导体材料,其有机化合物在治疗癌症方面有着独特的功效。下图为工业上利用锗锌矿(主要成分GeO2和ZnS)来制备高纯度锗的流程。
已知:
1.丹宁是一种有机沉淀剂,可与四价锗络合形成沉淀;
2.GeCl4易水解,在浓盐酸中溶解度低。
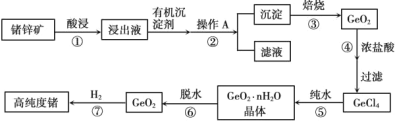
(1)锗元素在周期表中的位置:_____。
(2)步骤②操作A方法是_____。
(3)步骤③中的物质在_____(填仪器名称)中加热。
(4)步骤④不能用稀盐酸,原因可能是_____。
(5)写出步骤⑦的化学方程式_____。
Ⅱ.将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出晶体Cu(NH3)4SO4·H2O。
(1)Cu2+基态核外电子排布式为 _________;1mol [Cu(NH3)4]2+中![]() 键的数目为_______。
键的数目为_______。
(2)SO42-的S原子轨道杂化类型_______________。
(3)NH3极易溶于H2O中,原因为______________________。
【答案】第四周期第ⅣA族 过滤 坩埚 HCl浓度大可抑制四价锗水解,使GeO2充分反应,获得GeCl4沉淀 GeO2+2H2![]() Ge+2H2O 1s22s22p63s23p63d9 或[Ar]3d9 16NA sp3 NH3与H2O之间能形成氢键
Ge+2H2O 1s22s22p63s23p63d9 或[Ar]3d9 16NA sp3 NH3与H2O之间能形成氢键
【解析】
酸浸锗锌矿,浸出液中含有四价锗离子和锌离子,加入有机沉淀剂丹宁与四价锗络合形成沉淀,过滤后得到含有锗的沉淀,将沉淀焙烧得到GeO2;用浓盐酸溶解GeO2生成GeCl4,GeCl4在浓盐酸中溶解度低,过滤得GeCl4;GeCl4在纯水中水解生成GeO2·nH2O,GeO2·nH2O脱水后得到较纯净的GeO2,用氢气加热还原GeO2得到高纯度Ge,据此解答。
Ⅰ. (1)Ge与Si都是常见的半导体材料,Ge与Si同属第ⅣA族元素,且Ge在Si的下一周期,即锗在第四周期第ⅣA族,故答案为:第四周期第ⅣA族;
(2)经过步骤②操作A得到沉淀和滤液,所以,该操作方法是过滤,故答案为:过滤;
(3)焙烧在坩埚中进行,故答案为:坩埚;
(4)HCl浓度大可抑制四价锗水解,使GeO2充分反应,同时GeCl4在浓盐酸中溶解度低,易获得GeCl4沉淀,故答案为:HCl浓度大可抑制四价锗水解,使GeO2充分反应,获得GeCl4沉淀;
(5)用氢气加热还原GeO2得到高纯度Ge,反应的方程式为:GeO2+2H2![]() Ge+2H2O,故答案为:GeO2+2H2
Ge+2H2O,故答案为:GeO2+2H2![]() Ge+2H2O;
Ge+2H2O;
Ⅱ.(1)Cu是29号元素,Cu2+核外有27个电子,Cu2+基态核外电子排布式为:1s22s22p63s23p63d9 或[Ar]3d9,1个[Cu(NH3)4]2+中含12个N-H键,4个配位键,配位键和N-H键都属于![]() 键,所以,1mol[Cu(NH3)4]2+中含12+4=16mol
键,所以,1mol[Cu(NH3)4]2+中含12+4=16mol![]() 键,即1mol[Cu(NH3)4]2+含16NA
键,即1mol[Cu(NH3)4]2+含16NA![]() 键,故答案为:16NA;
键,故答案为:16NA;
(2)SO42-的中心原子S的![]() 键数=4,孤电子对数=
键数=4,孤电子对数=![]() =0,则S的价层电子对数=4+0=4,故SO42-的中心S原子的轨道杂化类型为sp3杂化,故答案为:sp3;
=0,则S的价层电子对数=4+0=4,故SO42-的中心S原子的轨道杂化类型为sp3杂化,故答案为:sp3;
(3)NH3和H2O之间能形成氢键,导致NH3易溶于H2O中,故答案为:NH3与H2O之间能形成氢键。

【题目】甲醇既可用于基本有机原料,又可作为燃料用于替代矿物燃料。
(1)以下是工业上合成甲醇的反应:![]()
![]() 下表所列数据是该反应在不同温度下的化学平衡常数
下表所列数据是该反应在不同温度下的化学平衡常数![]() .
.
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断反应I为 ______ 热反应(填“吸”或“放”) ![]() 某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得
某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得![]() ,则CO的转化率为 ______ ,此时的温度为 ______ 从表中选择.
,则CO的转化率为 ______ ,此时的温度为 ______ 从表中选择.
(2)已知在常温常压下:
①![]()
②![]()
③![]()
则反应![]() ______
______ ![]() 用
用![]() 、
、![]() 、
、![]() 表示
表示
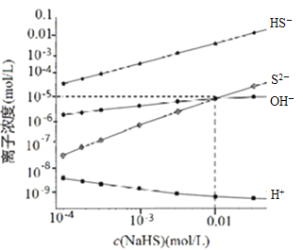
(3)处理废水时,最后![]() 以
以![]() 形式除去,当
形式除去,当![]() 时,
时,![]() 沉淀完全,此时溶液的
沉淀完全,此时溶液的![]() ______ (已知,
______ (已知,![]() ,
,![]() )
)