题目内容
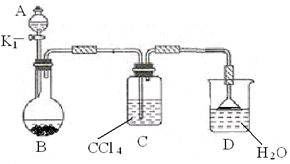
如图所示,是一个制取氯气并以氯气为原料进行特定反应的装置,其中各试剂瓶装的试剂为:B(氢硫酸)、C(溴化亚铁溶液)、D(碘化钾淀粉溶液)、E(混有SO2的氯化钡溶液)、F(水)、H(紫色石蕊试液)。
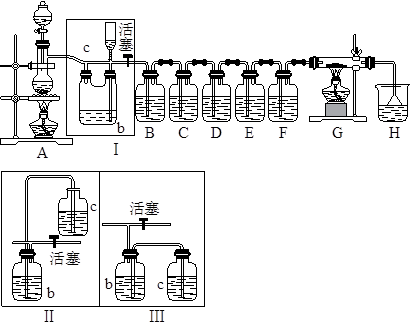
(1)A是氯气发生装置,其离子反应方程式是:__________。
(2)Ⅰ中b瓶内加入的液体最好是____________。
(3)用图示的Ⅱ或Ⅲ代替Ⅰ是否可行?________,简要说明理由_____________________________。
(4)实验开始时,先点燃A处酒精灯,打开分液漏斗旋塞和Ⅰ处活塞,让氯气充满整个装置,再点燃G处酒精灯,回答下列问题:
①怎样证明氯气已充满整个装置?_____________。
②下列装置中的现象是C______________________;
D________;E____________;F________________。
(5)G装置的硬质玻璃管内盛有碳粉,发生氧化还原反应,其产物为二氧化碳和氯化氢,写出G中反应的化学方程式_______________________。装置F的作用是______________________。
(6)在H处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是______________________________。
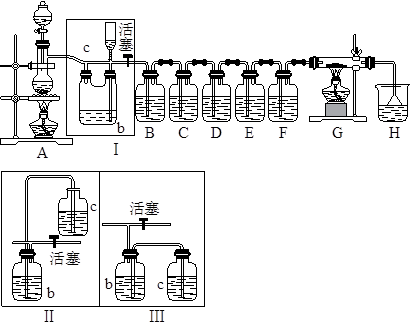
(1)A是氯气发生装置,其离子反应方程式是:__________。
(2)Ⅰ中b瓶内加入的液体最好是____________。
(3)用图示的Ⅱ或Ⅲ代替Ⅰ是否可行?________,简要说明理由_____________________________。
(4)实验开始时,先点燃A处酒精灯,打开分液漏斗旋塞和Ⅰ处活塞,让氯气充满整个装置,再点燃G处酒精灯,回答下列问题:
①怎样证明氯气已充满整个装置?_____________。
②下列装置中的现象是C______________________;
D________;E____________;F________________。
(5)G装置的硬质玻璃管内盛有碳粉,发生氧化还原反应,其产物为二氧化碳和氯化氢,写出G中反应的化学方程式_______________________。装置F的作用是______________________。
(6)在H处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是______________________________。
(1)MnO2+4H++2Cl-(浓)△Mn2++Cl2↑+2H2O
(2)饱和食盐水
(3)Ⅱ可行,Ⅲ不可行 Ⅱ原理同Ⅰ,而Ⅲ中因c瓶口密封,体积不能改变,压强增大会有危险
(4)①观察,当整个装置内充满黄绿色气体时,说明氯气已充满整个装置
②溶液由浅绿色变为深红棕色 溶液变蓝 生成白色沉淀 溶液变为浅黄绿色
(5)C+2H2O+2Cl2△CO2+4HCl 向G中提供反应所需的水蒸气
(6)生成HCl使紫色石蕊试液变红色,剩余的氯气又与水反应生成HClO,起漂白作用,使红色褪去
(2)饱和食盐水
(3)Ⅱ可行,Ⅲ不可行 Ⅱ原理同Ⅰ,而Ⅲ中因c瓶口密封,体积不能改变,压强增大会有危险
(4)①观察,当整个装置内充满黄绿色气体时,说明氯气已充满整个装置
②溶液由浅绿色变为深红棕色 溶液变蓝 生成白色沉淀 溶液变为浅黄绿色
(5)C+2H2O+2Cl2△CO2+4HCl 向G中提供反应所需的水蒸气
(6)生成HCl使紫色石蕊试液变红色,剩余的氯气又与水反应生成HClO,起漂白作用,使红色褪去
(2)b瓶的作用是贮存多余的Cl2,试剂最好为饱和食盐水。
(3)Ⅱ原理同Ⅰ,可代替Ⅰ;Ⅲ中c瓶口密封,不安全。
(4)①当黄绿色气体充满整个装置时,说明Cl2充满。
②Cl2有强氧化性,可将Fe2+、Br-、I-、SO2氧化为Fe3+、Br2、I2、SO,故C中溶液由浅绿色变为深红棕色;D中溶液变蓝;E中产生白色沉淀BaSO4;F中由于吸收了Cl2变为浅黄绿色。
(5)C+2H2O+2Cl2△CO2+4HCl,F的作用是提供水蒸气。
(6)生成HCl使溶液变红,剩余Cl2与水反应生成HClO又起漂白作用。
(3)Ⅱ原理同Ⅰ,可代替Ⅰ;Ⅲ中c瓶口密封,不安全。
(4)①当黄绿色气体充满整个装置时,说明Cl2充满。
②Cl2有强氧化性,可将Fe2+、Br-、I-、SO2氧化为Fe3+、Br2、I2、SO,故C中溶液由浅绿色变为深红棕色;D中溶液变蓝;E中产生白色沉淀BaSO4;F中由于吸收了Cl2变为浅黄绿色。
(5)C+2H2O+2Cl2△CO2+4HCl,F的作用是提供水蒸气。
(6)生成HCl使溶液变红,剩余Cl2与水反应生成HClO又起漂白作用。

练习册系列答案
相关题目
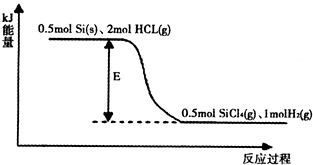


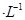 的溶液缓缓通入100 mLCl2(标准状况),溶液由浅绿色逐渐变黄色;继续通人Cl2,溶液黄色加深,变为棕黄色。
的溶液缓缓通入100 mLCl2(标准状况),溶液由浅绿色逐渐变黄色;继续通人Cl2,溶液黄色加深,变为棕黄色。