题目内容
【题目】在学习了化学反应速率知识后,某研究性学习小组进行了科学探究活动。
[探究活动一]探究金属与不同酸反应的反应速率:常温下,用经过砂纸打磨的铝片中取两片质量相等、表面积相同的铝片,分别加入到盛有体积相同、c(H+)相同,足量的稀硫酸和稀盐酸溶液的两支试管中,发现铝片在稀盐酸中消失的时间比在稀硫酸中短。
(1)对[探究活动一]实验现象发生的原因,请你帮该研究性学习小组提出两个假设:
假设Ⅰ_______________________________。
假设Ⅱ_______________________________。
并请你设计实验对以上假设进行验证:
验证假设Ⅰ_______________________________。
验证假设Ⅱ_______________________________。
[探究活动二]某小组在实验室测定氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率。
(2)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)2NH3(g)+CO2(g).
实验测得不同温度下的平衡数据列于下表:
温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
①可以判断该分解反应已经达到化学平衡状态的是 .
A.2v(NH3)=v(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时的分解平衡常数: .
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量 (填“增加”、“减小”或“不变”).
④氨基甲酸铵分解反应的焓变△H 0,熵变△S 0(填>、<或=).
(3)已知:NH2COONH4+2H2ONH4HCO3+NH3H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如下图所示.
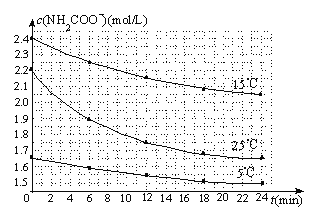
⑤计算25℃时,0~6min氨基甲酸铵水解反应的平均速率: .
⑥根据图中信息,如何说明水解反应速率随温度升高而增大: 。
【答案】(1)假设Ⅰ:Cl-对铝和酸的反应有促进作用
假设Ⅱ:Cl-对铝和酸的反应有抑制作用
验证假设Ⅰ:在铝和稀硫酸反应的容器中加入固体氯化钠,看是否加快放出氢气的速率
验证假设Ⅱ:在铝和稀盐酸反应的容器中加入固体硫酸钠,看是否减慢放出氢气的速率
(2)①BC;②1.6×10-8mol/L;③增加;④>;>;
(3)⑤0.05mol/(Lmin);⑥25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大.
【解析】
试题分析:(1)两片质量相等、表面积相同的铝片,分别加入到盛有体积相同、c(H+)相同,足量的稀硫酸和稀盐酸溶液的两支试管中,发现铝片在稀盐酸中消失的时间比在稀硫酸中短。根据对比实验的特征,可以提出假设,假设Ⅰ:Cl-对铝和酸的反应有促进作用;假设Ⅱ: Cl-对铝和酸的反应有抑制作用。设计实验验证提出的假设结论,验证假设Ⅰ:在铝和稀硫酸反应的容器中加入固体氯化钠,看是否加快放出氢气的速率;验证假设Ⅱ:在铝和稀盐酸反应的容器中加入固体硫酸钠,看是否减慢放出氢气的速率。
(2)①A项不能表示正、逆反应速率相等,A项错误;B.因为该反应的正反应方向气体分子数增大,则密闭容器中压强不变,反应达到平衡,B项正确;C.容器的体积不变,反应向右进行,气体的质量不断增加,密度不断增大,当密度不变时,反应达到平衡状态,C项正确;D.反应物是固体,NH3的体积分数始终为2/3,D项错误;答案选BC。
②需将25 ℃的总浓度转化为NH3和CO2的浓度:c(NH3)=2/3×4.8×10-3mol·L-1=3.2×10-3mol·L-1,c(CO2)=1/3×4.8×10-3mol·L-1=1.6×10-3mol·L-1,K=(3.2×10-3)2×1.6×10-3≈1.6×10-8。
③增大压强,平衡向逆反应方向移动,固体质量增大。
④根据表中数据判断,随着温度升高,平衡正向移动,该反应为吸热反应,焓变(△H)大于0;根据气态物质的熵大于液态物质的熵判断,该反应熵变(△S)大于0。
(3)⑤根据题图数据,25℃时,0~6min,v(NH2COO-)=(2.2mol/L-1.9mol/L)÷6min=0.05molL-1min-1.
⑥根据图中信息,25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大, 说明水解反应速率随温度升高而增大。



