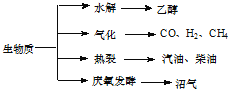
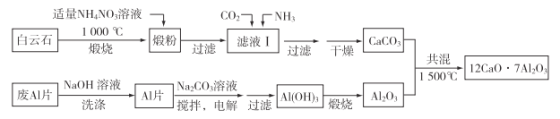
题目内容
【题目】将足量的 CO2不断通入 KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入 CO2的量的关系可表示为

【答案】C
【解析】
试题分析:将二氧化碳气体通入KOH、Ba(OH)2、KAlO2的混合溶液,通入CO2后,发生反应:2OH-+CO2═CO32-+H2O,Ca2++CO32-═CaCO3 ↓,即CO2先与Ba(OH)2反应(有沉淀BaCO3生成),当Ba(OH)2消耗完毕后再与KOH反应(此时无沉淀);最后与KAlO2反应(有沉淀Al(OH)3生成),当OH-反应完后,溶液中存在 K2CO3 和[Al(OH)4]-,因KAlO2碱性比K2CO3强,[Al(OH)4]-先反应,生成了氢氧化铝沉淀,反应方程式为:2K[Al(OH)4]+CO2=2Al(OH)3↓+K2CO3 +H2O,沉淀增加; [Al(OH)4]-反应结束后,碳酸钾开始反应生成碳酸氢钾,沉淀暂时没有变化;碳酸钾消耗完后,CaCO3 开始反应,沉淀逐渐减少,反应方程式为:CaCO3+CO2+H2O=Ca(HCO3)2,直至碳酸钙沉淀消失,最后只剩下氢氧化铝沉淀,生成沉淀的量和通入二氧化碳的量的关系以二氧化碳的体积为横坐标,以沉淀的物质的量为纵坐标的图象的过程中图形应是:出现沉淀(BaCO3),平台,沉淀增加[因有Al(OH)3生成];过量的CO2还可以继续与K2CO3反应得到KHCO3,继续过量的CO2还可以使BaCO3沉淀溶解,最后是Al(OH)3沉淀,所以接着的图形应该为:平台,沉淀(BaCO3)减少,平台,故整个过程的图形应为:出现沉淀(BaCO3),平台,沉淀增加[因有Al(OH)3生成],平台,沉淀(BaCO3)减少,平台,满足以上关系的图象为C。答案选C。

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案
相关题目