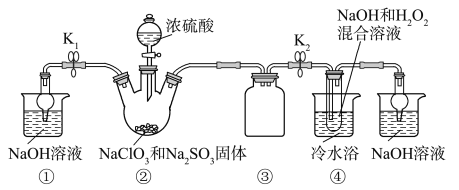
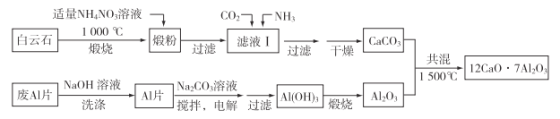
题目内容
【题目】现有常温下的六份溶液:①0.01mol/LCH3COOH溶液;②0.01mol/LHCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01mol/LCH3COOH溶液与pH=12的氨水等体积混合后所得溶液;⑥0.01mol/LHCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
⑴其中水的电离程度最大的是 (选填序号,下同),水的电离程度相同的是 ;
⑵若将②、③混合后所得溶液pH=7,则消耗溶液的体积:② ③(选填“>”、“<”或“=”);
⑶将六份溶液同等程度稀释10倍后,溶液的pH:① ②,③ ④(选填“>”、“<”或“=”);
⑷某二元酸H2A电离方程式是H2A=H++HA-、HA-![]() A2-+H+。回答下列问题:
A2-+H+。回答下列问题:
①Na2A溶液显__________性,理由是__________(用离子方程式表示).
②若0.1mol/LNaHA溶液的pH=2,则0.1mol/LH2A溶液中氢离子的物质的量浓度可能__________0.11mol/L(填“<”、“>”或“=”)理由是______________.
③0.1mol/LNaHA溶液中各离子浓度由大到小的顺序是______________.
【答案】(1)⑥ ②③④(2)> (3)> >
(4)①碱性 A2-+H2O![]() HA-+OH-
HA-+OH-
②< H2A第一步电离产生的H+对HA-的电离起了抑制作用
③c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
【解析】
试题分析:(1)水属于弱电解质,存在电离平衡H2O![]() H++OH-,根据电离出的离子可知酸或碱抑制水的电离,而盐类的水解则促进水的电离。pH=12的氨水,说明氨水的浓度大于0.01mol/L,所以⑤中氨水是过量的,所以溶液显碱性。在⑥中二者恰好反应生成氯化钠,氯化钠是不能发生水解的,所以在该溶液中水的电离没有被抑制,而在①②③④⑤中均是抑制水的电离的,因为②③④中H+浓度或OH-的浓度均是0.01mol,所以对水的电离抑制程度是相同的。即水的电离程度最大的是⑥,水的电离程度相同的是②③④。
H++OH-,根据电离出的离子可知酸或碱抑制水的电离,而盐类的水解则促进水的电离。pH=12的氨水,说明氨水的浓度大于0.01mol/L,所以⑤中氨水是过量的,所以溶液显碱性。在⑥中二者恰好反应生成氯化钠,氯化钠是不能发生水解的,所以在该溶液中水的电离没有被抑制,而在①②③④⑤中均是抑制水的电离的,因为②③④中H+浓度或OH-的浓度均是0.01mol,所以对水的电离抑制程度是相同的。即水的电离程度最大的是⑥,水的电离程度相同的是②③④。
(2)pH=12的氨水,说明氨水的浓度大于0.01mol/L,所以②③等体积混合后氨水过量,溶液显碱性,要使溶液显中性,盐酸的体积必须大于氨水的体积。
(3)醋酸和盐酸起始浓度相同,①②稀释相同倍数后二者的浓度仍然相等,但是醋酸是弱酸,部分电离,氢离子浓度较小,pH较大,则溶液的pH:①>②;③④稀释前pH相等,但稀释后氨水继续电离,③中OH-的物质的量要大于④中的,所以溶液的pH:③>④。
(4)①根据H2A的电离是分步电离可以知道H2A是弱酸,所以Na2A溶液显碱性,水解原理是A2-+H2O ![]() HA-+OH- 。
HA-+OH- 。
②0.1molL-1H2A溶液,H2A═H++HA-,电离出0.1mol/LH+,0.1molL-1NaHA溶液的pH=2,则由HA-H++A2-可知,电离出0.01mol/LH+,但第一步电离生成的H+抑制了HA-的电离,所以溶液中氢离子的物质的量浓度小于0.1mol/L+0.01mol/L=0.11mol/L。
③NaHA溶液显酸性,存在HA-H++A2-,则c(Na+)>c(HA-)>c(H+)>c(OH-),结合水的电离H2OH++OH-,同时有部分A2-发生水解,使c(A2-)减小,所以c(H+)>c(A2-),即NaHA溶液中各种离子浓度由大到小的顺序为c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)。