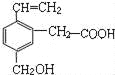
题目内容
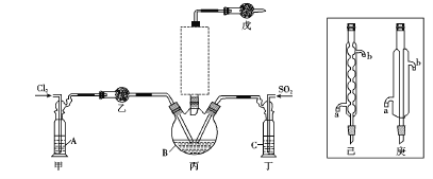
【题目】淀粉水解的产物(C6H12O6)用硝酸酸化可以制备草酸(H2C2O4),装置如图所示:
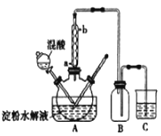
实验过程如下:
①将1:1的淀粉水乳液与少许98%硫酸加入烧杯中,水浴加热30 min;
②将一定量的淀粉水解液加入三颈烧瓶中;
③在5560℃条件下,缓慢滴加混酸(65%HNO3与98%H2S04的质量比为4 : 3)溶液;
④反应3h左右,冷却、过滤后再重结晶得二水合草酸晶体(H2C2O4·2H2O)。
硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3=3H2C2O4+9NO2↑+3NO↑+9 H2O
C6H12O6+8HNO3=6CO2↑+8NO↑+10H2O
C6H12O6+2HNO3=6CO2↑+2NO↑+4H2O
请回答下列问题:
(1)实硷①加入98%硫酸少许的目的是_____________。
(2)检验淀粉是否水解完全所用的试剂为____________。
(3)冷凝水的进口是_______(填“a”或“b”)。
(4)装置B的作用为___________。
(5)实验中若混酸滴加过快,将导致草酸产量下降,其原因是______________。
(6)当尾气中n(NO2) :n(NO)=1:1时,过量的NaOH溶液能将氮氧化物全部吸收,只生成一种钠盐,化学方程式为__________。若用步驟④后含硫酸的母液来吸牧氮氧化物,其优点是_____,缺点是________。
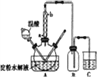
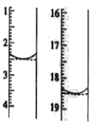
(7)二水合草酸晶体纯度的测定。称取该晶体0.12g,加水溶解,用0.020 mol L-1的酸性KMnO4溶液滴定(杂质不参与反应),该反应的离子方程式为 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2+8H2O。此时溶液颜色由_____变为_____。滴定前后液面读数如图所示,则该晶体中二水合草酸的质量分数为____________。
【答案】 加快淀粉水解的速度(或起到催化剂的作用) 碘水 a 作安全瓶 硝酸浓度过大.导致葡萄糖被氧化为C〇2,且H2C2O4进一步被氧化 NO2+NO+2NaOH=2NaNO2+H2O 提高硝酸利用率(或循环使用氮氧化物): NOx (或循环使用氮氧化物)吸收不完全 无色 浅紫色 84.0%
【解析】(1)实硷①加入98%硫酸少许的目的是:淀粉水解时,硫酸能起到催化剂的作用,加快淀粉水解的速度;(2)检验淀粉是否水解完全所用的试剂为碘水,溶液由蓝色变为无色且30S不变色即水解完全;(3)选择a作为冷凝水入口,下进上出,可以加快冷凝速度;(4)装置B起到安全瓶的作用,防止尾气吸收时引起倒吸;(5)实验中温度过高 、硝酸浓度过大,都会导致H2C2O4进一步被氧化 ,故要控制混酸滴加速度;(6)当尾气中n(NO2) :n(NO)=1:1时,过量的NaOH溶液能将氮氧化物全部吸收,只生成一种钠盐亚硝酸钠(亚硝酸钠中氮的化合价为+3价,为二氧化氮和一氧化氮的中间价态),其化学方程式为:NO2+NO+2NaOH=2NaNO2+H2O;若用步驟④后含硫酸的母液来吸牧氮氧化物,其优点是提高硝酸利用率,循环使用氮氧化物,缺点是NOx吸收不完全;(7)用酸性高锰酸钾滴定草酸,当最后一滴酸性高锰酸钾溶液滴入时,显示其颜色,则溶液颜色由无色变为浅紫色,滴定前后液面读数如图所示,反应为:2MnO4- +5H2C2O4 + 6H+=2Mn2++10CO2+8H2O;则:
2MnO4- --------------------------------------------5H2C2O4
2 5
(18.5-2.5)×10-3×0.020mol/L n
解得n=0.8×10-3mol
故m(二水合草酸)=126g/mol×0.8×10-3mol=0.1008g
则该草酸晶体样品中二水合草酸的质量分数ω=![]() ×100% = 84.0%。
×100% = 84.0%。

 百年学典课时学练测系列答案
百年学典课时学练测系列答案