题目内容
【题目】二氯化砜(SO2Cl2)是一种无色液体,主要用于有机物和无机物的氯化等。其熔点为-54.1℃.沸点为69.2℃;常温下比较稳定,受热易分解,遇水剧烈反应生成硫酸和盐酸。
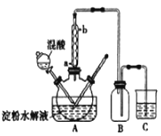
(1)制备。实验室可利用SO2和Cl2按下列装置制取少量SO2Cl2(丙中放有樟脑液,起催化作用)。已知SO2(g)+Cl2(g)![]() SO2Cl2(g) △H<0
SO2Cl2(g) △H<0
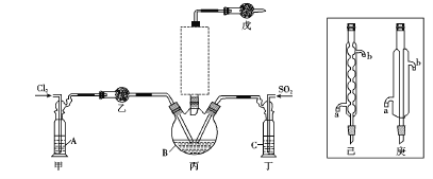
①可以用浓盐酸和酸性高锰酸钾制取氯气,该反应的化学方程式为 ;溶液A为 。
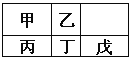
②上图实框中仪器己的名称为 ;反应装置图的虚框中未画出的仪器是 (填“己”或“庚”)。
③如果将丙装置放入冰水中,会更有利于二氯化砜的生成,其原因是 。
④下列有关说法错误的是 (填编号)。
a.乙、戊装置相同,在实验中的作用也完全相同
b.甲、丁装置为洗气装置,可用于气体的除杂和干燥
c.组装仪器后首先要进行的操作是检查装置的气密性
d.为提高反应物的利用率,可控制甲、丁装置中产生气泡的速率相等
(2)提纯。将收集到的产物进行减压蒸馏,减压蒸馏的目的是 。
(3)测定。取1.00g蒸馏后液体,小心地完全溶于水,向所得的溶液中加入足量氯化钡溶液,测得生成沉淀的质量为1.60g,则所得蒸馏成分中二氯化砜的质量百分含量为 %。
(4)贮存。二氯化砜应储存于阴凉、干燥、通风良好的库房。但久置后微显黄色,其原因是 。
【答案】(1)①16HCl(浓)+2KMnO4=5Cl2↑+2MnCl2+2KCl+8H2O;饱和的氯化钠溶液。
②球形冷凝管;己。
③该反应是放热反应,降低温度能使平衡向右移动,有利于二氯化砜的生成。 ④a
(2)降低二氯化砜的沸点,减少二氯化砜的分解。(3)92.70
(4)二氯化砜自身分解生成的氯气溶于二氯化砜中。
【解析】
试题分析:制备的二氧化硫中含有水蒸气,制备的氯气中含有HCl、水蒸气,SO2C12遇水剧烈反应,需要进行干燥与除杂,甲装置为除去氯气中HCl,盛放饱和食盐水,乙装置干燥氯气;丁装置干燥二氧化硫,可以盛放浓硫酸,戊防止空气中水蒸气进入丙中。
(1)①高锰酸钾溶液与浓盐酸反应的方程式为16HCl(浓)+2KMnO4=5Cl2↑+2MnCl2+2KCl+8H2O;除去氯气中的氯化氢可以使用饱和食盐水,即溶液A是饱和的氯化钠溶液;
②由仪器己的结构特征可知己为球形冷凝管;球形冷凝管冷凝面积较直形冷凝管大,冷凝效率稍高,故虚框中未画出的仪器最好选用己;
③该反应是放热反应,降低温度能使平衡向右移动,因此有利于二氯化砜的生成;
④a.乙、戊装置相同,乙是干燥氯气,戊防止空气中水蒸气进入丙中,作用不同,a错误;b.甲、丁装置为洗气装置,可用于气体的除杂和干燥,b正确;c.组装仪器后首先要进行的操作是检查装置的气密性,c正确;d.为提高反应物的利用率,可控制甲、丁装置中产生气泡的速率相等,d正确,答案选a。
(2)SO2Cl2常温下比较稳定,受热易分解,减压蒸馏可以降低其沸点,防止分解;
(3)设所得馏分中二氯化砜的质量百分含量为x,则:
SO2Cl2~H2SO4~BaSO4
135 233
1.00g×x 1.6g
所以135:233=1.00g×x:1.6g
解得x=92.7%
(4)SO2Cl2久置后分解会生成氯气,可能是溶解氯气所致,因此久置后微显黄色的原因是二氯化砜久置后分解会生成氯气的溶解再二氯化砜中。