题目内容
3.卤族元素随核电荷数的增加,下列叙述正确的是( )| A. | 单质的颜色逐渐加深 | B. | 气态氢化物的稳定性逐渐增强 | ||
| C. | 单质的熔点逐渐升高 | D. | 单质的氧化性逐渐增强 |
分析 A.卤族元素单质的颜色随着原子序数增大而依次是浅黄绿色-黄绿色-红棕色-紫红色;
B.元素的非金属性越强,其氢化物的稳定性越强;
C.分子晶体熔沸点与相对分子质量成正比;
D.卤族元素非金属性越强,其单质的氧化性越强.
解答 解:A.卤族元素由上到下,单质的颜色是逐渐加深的,依次是浅黄绿色-黄绿色-红棕色-紫红色,故A正确;
B.卤族元素非金属性随着核电荷数增大而减弱,则其氢化物的稳定性随着原子核电荷数增大而减弱,故B错误;
C.卤族元素单质都是分子晶体,分子晶体熔沸点与相对分子质量成正比,所以随着核电荷数增大其单质的熔沸点升高,故C正确;
D.卤族元素非金属性随着核电荷数增大而减弱,其单质的氧化性随着核电荷数增大而减弱,故D错误;
故选AC.
点评 本题考查同一主族元素性质递变规律,为高频考点,明确非金属性强弱判断方法及非金属性与氢化物的稳定性、单质的氧化性之间的关系即可解答,注意规律中的反常现象,题目难度不大.

练习册系列答案
相关题目
8.电石中的碳化钙和水能完全反应:CaC2+2H2O═C2H2↑+Ca(OH)2
使反应产生的气体排水,测量排出水的体积,可计算出标准状况乙炔的体积,从而可测定电石中碳化钙的含量.
(1)若用下列仪器和导管组装实验装置:
如果所制气体流向从左向右时,上述仪器和导管从左到右直接连接的顺序(填各仪器、导管的序号)是:6接3接1接5接2接4.
(2)仪器连接好后,进行实验时,有下列操作(每项操作只进行一次):
①称取一定量电石,置于仪器3中,塞紧橡皮塞.
②检查装置的气密性.
③在仪器6和5中注入适量水.
④待仪器3恢复到室温时,量取仪器4中水的体积(导管2中的水忽略不计).
⑤慢慢开启仪器6的活塞,使水逐滴滴下,至不发生气体时,关闭活塞.
正确的操作顺序(用操作编号填写)是②①③⑤④.
(3)若实验产生的气体有难闻的气味,且测定结果偏大,这是因为电石中含H2S杂质.
(4)若实验时称取的电石1.60g,测量排出水的体积后,折算成标准状况乙炔的体积为448mL,此电石中碳化钙的质量分数80%.
使反应产生的气体排水,测量排出水的体积,可计算出标准状况乙炔的体积,从而可测定电石中碳化钙的含量.
(1)若用下列仪器和导管组装实验装置:
| 序号 | 1 | 2 | 3 | 4 | 5 | 6 |
| 导管及仪器 | 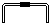 |  |  | 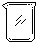 |  |  |
| 每个橡皮塞上都打了两个孔 | ||||||
(2)仪器连接好后,进行实验时,有下列操作(每项操作只进行一次):
①称取一定量电石,置于仪器3中,塞紧橡皮塞.
②检查装置的气密性.
③在仪器6和5中注入适量水.
④待仪器3恢复到室温时,量取仪器4中水的体积(导管2中的水忽略不计).
⑤慢慢开启仪器6的活塞,使水逐滴滴下,至不发生气体时,关闭活塞.
正确的操作顺序(用操作编号填写)是②①③⑤④.
(3)若实验产生的气体有难闻的气味,且测定结果偏大,这是因为电石中含H2S杂质.
(4)若实验时称取的电石1.60g,测量排出水的体积后,折算成标准状况乙炔的体积为448mL,此电石中碳化钙的质量分数80%.
14.下列四个数据是不同条件下测出的合成氨的反应的速率,其中最慢的是( )
| A. | v(NH3)=0.15 mol/L•min | B. | v(H2)=0.1 mol/L•min | ||
| C. | v(N2)=0.1 mol/L•min | D. | v(N2)=0.002 mol/L•s |
18.铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列说法正确的是( )
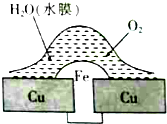

| A. | 此过程中铜被腐蚀 | |
| B. | 此过程中电子从Cu移向Fe | |
| C. | 铁铆钉表面发生的电极反应为Fe-3e-═Fe3+ | |
| D. | 在金属表面刷上一层油漆,能延缓铁铆钉的腐蚀 |
8.下列离子方程式正确的是( )
| A. | Zn与稀H2SO4反应:Zn+H+═Zn2++H2↑ | |
| B. | Na2CO3溶液与足量盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| C. | Cl2与NaOH溶液反应:Cl2+2OH-═2Cl-+H2O | |
| D. | MgCl2溶液与过量氨水反应:Mg2++2OH-═Mg(OH)2↓ |
15.通过观察化学实验现象,分析归纳出正确的结论,是学习化学科学最基本的技能之一.下列由实验现象得出正确结论的是( )
| 选项 | 实验现象 | 结论 |
| A | 把相同大小的一块铝和镁分别投入相同浓度的NaOH溶液中:铝溶解有气泡放出,而镁没有任何变化 | 由此得出:铝的金属性比镁强 |
| B | 取一块铝箔,用酒精灯点燃:铝箔只熔化成液体而没有脱落 | 由此得出:铝不易燃烧 |
| C | 向氯化铵溶液中投入一铝片:铝片上产生大量气泡 | 由此得出:该气体是氨气 |
| D | 向氯化铝溶液中逐滴滴加NaOH溶液至过量:先产生白色沉淀,后沉淀逐渐溶解,最后沉淀完全消失 | 由此得出:氢氧化铝能溶于强碱溶液 |
| A. | A | B. | B | C. | C | D. | D |
13.阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是( )
| A. | 58.5 g的氯化钠固体中含有NA个氯化钠分子 | |
| B. | 0.1 L 3 mo1•L-1的NH4NO3溶液中含有的NH4+数目为0.3×6.02×1023 | |
| C. | 5.6 g铁粉与硝酸反应失去的电子数一定为0.3×6.02×1023 | |
| D. | 4.5 g SiO2晶体中含有的硅氧键数目为0.3×6.02×1023 |
 置换反应的通式可表示为如图所示:请回答下列问题:
置换反应的通式可表示为如图所示:请回答下列问题: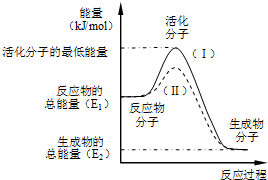 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示.请认真观察如图,然后回答问题.
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示.请认真观察如图,然后回答问题.