题目内容
18.铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列说法正确的是( )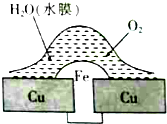
| A. | 此过程中铜被腐蚀 | |
| B. | 此过程中电子从Cu移向Fe | |
| C. | 铁铆钉表面发生的电极反应为Fe-3e-═Fe3+ | |
| D. | 在金属表面刷上一层油漆,能延缓铁铆钉的腐蚀 |
分析 钢铁在接近中性的潮湿的空气中的腐蚀就属于吸氧腐蚀,其电极反应如下:负极(Fe):2Fe-4e-=2Fe2+ 正极(C):2H2O+O2+4e-=4OH- 总反应方程式:2Fe+O2+2H2O=2Fe(OH)2.
解答 解:A、因铁比铜活泼,所以在腐蚀过程中铁失电子被氧化腐蚀,故A错误;
B、在原电池中,电子流动方向是由负极铁流向正极铜,故B错误;
C、铁钉表面发生的反应为Fe-2e-═Fe2+,故C错误.
D、在金属表面刷上油漆后,能隔绝空气和水,故能延缓铆钉的腐蚀,故D正确.
故选D.
点评 本题考察了钢铁的吸氧腐蚀原理.要注意,在钢铁腐蚀中,铁失电子变成亚铁离子.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
9.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 25℃时,pH=3的1.0L NaHSO3溶液中,含Na+数目为0.001NA | |
| B. | 常温下,1L pH=12的Ba(OH)2 溶液中含OH-的数目为2NA | |
| C. | 1L0.1mol•L-1的氨水中含有的NH3分子数小于0.1 NA | |
| D. | 在高温高压下,28gN2和6g H2充分反应生成NH3的分子数为2NA |
6.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 常温常压下22.4LNH3中含有的分子总数小于NA | |
| B. | 1molFe3+完全水解生成氢氧化铁胶体粒子的数目为NA | |
| C. | 1molCl2与足量NaOH溶液反应,转移的电子数为2NA | |
| D. | 0.1 mol/L的醋酸钠溶液中含CH3COOH、CH3COO- 粒子总数为0.1 NA |
13.含NaOH 0.5mol的稀溶液与足量稀盐酸反应,放出28.7kJ的热量,表示该反应的热化学方程式正确的是( )
| A. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=+28.7 kJ•mol-1 | |
| B. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=-28.7 kJ•mol-1 | |
| C. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=+57.4 kJ•mol-1 | |
| D. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=-57.4 kJ•mol-1 |
3.卤族元素随核电荷数的增加,下列叙述正确的是( )
| A. | 单质的颜色逐渐加深 | B. | 气态氢化物的稳定性逐渐增强 | ||
| C. | 单质的熔点逐渐升高 | D. | 单质的氧化性逐渐增强 |
10.下列叙述正确的是( )
| A. | 构成分子晶体的粒子中一定含有共价键 | |
| B. | 在离子晶体中不可能存在非极性键 | |
| C. | 离子化合物中可能含有共价键 | |
| D. | 在原子晶体中不可能存在极性共价键 |
7.常温下,在由水电离出的c(H+)=1.0×10-13 mol/L溶液中一定可以大量共存的离子组是( )
| A. | Na+、NH4+、Cl-、CO32- | B. | K+、Na+、Cl-、NO3- | ||
| C. | K+、Na+、NO3-、I- | D. | Al3+、Na+、HCO3-、NO3- |
8.某地污水中含有Zn2+、Hg2+、Fe3+和Cu2+4种阳离子.甲、乙、丙3位同学设计的从该污水中回收金属铜的方案如下.
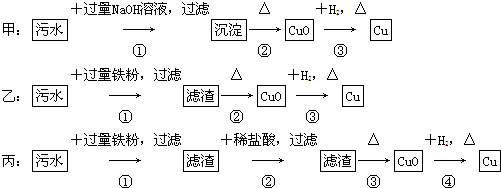
下列判断正确的是( )

下列判断正确的是( )
| A. | 三种实验方案中都能制得纯净的铜 | |
| B. | 乙方案中加过量铁粉可以将4种阳离子全部还原 | |
| C. | 甲方案中的反应涉及置换、分解、化合、复分解4种反应类型 | |
| D. | 丙方案会产生环境污染 |
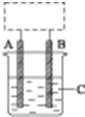 某学生设计了如图所示的装置(框内部分未画出),在装置内起初发生的反应为Cu+H2SO4═
某学生设计了如图所示的装置(框内部分未画出),在装置内起初发生的反应为Cu+H2SO4═