��Ŀ����
����Ŀ������A��B��C��D��E��F���ֶ���������Ԫ�أ�ԭ����������������֪A����̬�⻯������������������ˮ���ﷴӦ��Bԭ�������������ǵ��Ӳ�����3����C+��D3+���ӵĵ��Ӳ�ṹ��ͬ��B��E����ͬһ���壮
��ش��������⣺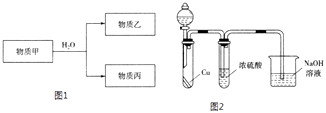
��1��E��Ԫ�����ڱ��е�λ����
��2������Ԫ���γɵļ������У��뾶��С�����������ӷ��ţ���
��3��������Ԫ���е�һ�ֻ�����ɵ����ʼ��Է�����ͼ1��Ӧ��
�����Ҿ���Ư���ԣ����ҵĵ���ʽΪ ��
��������ˮ��Һ��ǿ������Һ�����Ϊ�����ѧʽ����
������Ϊ��Ԫ���ᣬ����������ǿ�ᡢ��������ǿ����ҵ�����Ϊ���õ��뷽��ʽ��ʾ����������ǿ�ᡢ��������ǿ���ԭ�� ��
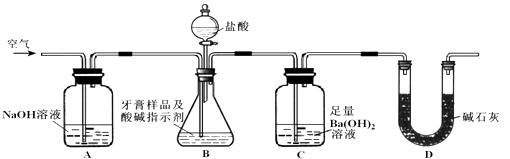
������������Ϊ����ɫ����ͬѧ��Ϊ��Ũ������Ը�������ס���Ϊ��֤��۵��Ƿ���ȷ������ͼ2װ�ý���ʵ��ʱ����Һ©����Ӧ���������Լ����ƣ���ʵ������У�Ũ������δ�����������ݳ�������Һ��Ϊ����ɫ���ɴ˵ó��Ľ����� ��
���𰸡�
��1���������ڵ�VIA��
��2��Al 3+
��3��![]() ��Na��Na2O2������������AlO2��+H2O+H+?Al��OH��3?Al3++3OH����Ũ���Ũ����ܸ�������������������������Ũ����
��Na��Na2O2������������AlO2��+H2O+H+?Al��OH��3?Al3++3OH����Ũ���Ũ����ܸ�������������������������Ũ����
���������⣺A��B��C��D��E��F���ֶ���������Ԫ�أ�ԭ��������������A����̬�⻯������������������ˮ���ﷴӦ����A��NԪ�أ�
Bԭ�������������ǵ��Ӳ�����3����BΪOԪ�أ�
B��E����ͬһ���壬��E��SԪ�أ�FΪ����������Ԫ����ԭ����������E����FΪClԪ�أ�
C+��D3+���ӵĵ��Ӳ�ṹ��ͬ��Ϊ��������Ԫ�أ�C��D�ֱ�ΪNa��AlԪ�أ���1��E��SԪ�أ�Sԭ�Ӻ�����Ӳ�����������������������������������������Sԭ�Ӻ�����3�����Ӳ㡢������������6������Sλ�ڵ������ڵ�VIA�壬���Դ��ǣ��������ڵ�VIA�壻��2������Ԫ���γɵļ������У����Ӳ���Խ�ٵ�ԭ�Ӱ뾶ԽС�����Ӳ�ṹ��ͬ�����ӣ����Ӱ뾶����ԭ�������������С���⼸��Ԫ���γɵ����Ӱ뾶��С˳����S 2����Cl����N3����O 2����Na+��Al 3+ �� �������Ӱ뾶��С����Al 3+ �� ���Դ��ǣ�Al 3+����3�������Ҿ���Ư���ԣ�ΪHClO�����������������HCl��HClO������Oԭ�Ӻ�H��Clԭ��֮��ֱ���һ�Ե��ӣ�����ʽΪ ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ����������ˮ��Һ��ǿ������Һ�����ΪNa��Na2O2 �� ��ΪNaOH����Ϊ���������������Դ��ǣ�Na��Na2O2��������Ϊ��Ԫ���ᣬ����������ǿ�ᡢ��������ǿ���Ϊ������������Ϊ���⣬�����������������Ϊ����������ᣬ���������ܷ�����ʽ����Ҳ�ܷ�����ʽ���룬���뷽��ʽΪAlO2��+H2O+H+Al��OH��3Al3++3OH�� �� ������������������ǿ���ǿ����Һ�����Դ��ǣ�����������AlO2��+H2O+H+Al��OH��3Al3++3OH����������������Ϊ����ɫ������ΪNO����Ϊ������������ͬѧ��Ϊ��Ũ������Ը�������ס���Ϊ��֤��۵��Ƿ���ȷ������ͼ2װ�ý���ʵ��ʱ��Ũ�����Cu��Ӧ���ɶ������������Է�Һ©����Һ����Ũ���ᣬʵ������У�Ũ������δ�����������ݳ�������Һ��Ϊ����ɫ���������������Ũ���ᣬ˵����������������Ũ�����Ũ����ܸ������������
����������ˮ��Һ��ǿ������Һ�����ΪNa��Na2O2 �� ��ΪNaOH����Ϊ���������������Դ��ǣ�Na��Na2O2��������Ϊ��Ԫ���ᣬ����������ǿ�ᡢ��������ǿ���Ϊ������������Ϊ���⣬�����������������Ϊ����������ᣬ���������ܷ�����ʽ����Ҳ�ܷ�����ʽ���룬���뷽��ʽΪAlO2��+H2O+H+Al��OH��3Al3++3OH�� �� ������������������ǿ���ǿ����Һ�����Դ��ǣ�����������AlO2��+H2O+H+Al��OH��3Al3++3OH����������������Ϊ����ɫ������ΪNO����Ϊ������������ͬѧ��Ϊ��Ũ������Ը�������ס���Ϊ��֤��۵��Ƿ���ȷ������ͼ2װ�ý���ʵ��ʱ��Ũ�����Cu��Ӧ���ɶ������������Է�Һ©����Һ����Ũ���ᣬʵ������У�Ũ������δ�����������ݳ�������Һ��Ϊ����ɫ���������������Ũ���ᣬ˵����������������Ũ�����Ũ����ܸ������������
���Դ��ǣ�Ũ���Ũ����ܸ�������������������������Ũ���ᣮ