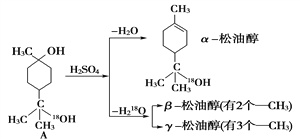
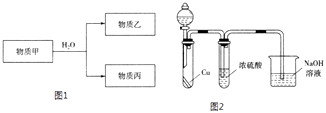
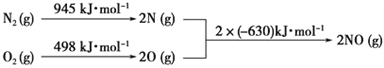
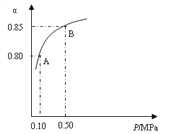
��Ŀ����
����Ŀ����ѧ��ȤС���ijƷ��������Ħ�����ɷּ��京����������̽���� ������ϣ�������Ħ������̼��ơ�����������ɣ������������ɷ���������ʱ���������ɣ�
��1��Ħ���������������Ķ��Լ��� ȡ����������Ʒ����ˮ�ɷֽ��衢���ˣ�
���������м������NaOH��Һ�����ˣ�����������NaOH��Һ��Ӧ�����ӷ���ʽ��
������������Һ����ͨ�����������̼���ټ������ϡ���ᣮ�۲쵽�������ǣ�
��2��������Ʒ��̼��ƵĶ����ⶨ ������ͼ��ʾװ�ã�ͼ�мг�������ȥ������ʵ�飬��ַ�Ӧ�ⶨC�����ɵ�BaCO3������������ȷ��̼��Ƶ�����������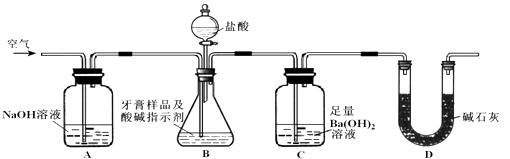
����ʵ����̻ش��������⣺
��ʵ����������������ͨ������������ó��˿ɽ���B��C�еķ�Ӧ���⣬���У�
��C�з�Ӧ����BaCO3�����ӷ���ʽ��
�����и����ʩ�У�������߲ⶨȷ�ȵ��������ţ�
a���ڼ�������֮ǰ��Ӧ�ž�װ���ڵ�CO2����
b���μ�����˹���
c����A��B֮������ʢ��Ũ�����ϴ��װ��
d����B��C֮������ʢ�б���̼��������Һ��ϴ��װ��
��ʵ����ȷ��ȡ8.00g��Ʒ���ݣ��������βⶨ�����BaCO3ƽ������Ϊ3.94g������Ʒ��̼��Ƶ���������Ϊ��BaCO3��Ħ������Ϊ197g/mol��
���𰸡�
��1��Al��OH��3+OH���TAlO2��+2H2O��ͨ��CO2�����а�ɫ�������ɣ�������������������������ܽ�
��2�������ɵ�CO2����ȫ������C�У�ʹ֮��ȫ��Ba��OH��2��Һ���գ�CO2+Ba2++2OH���TBaCO3��+H2O��cd��25%
���������⣺��1��������������NaOH��Һ��Ӧ����ƫ��������ˮ����Ӧ���ӷ���ʽΪAl��OH��3+OH���TAlO2��+2H2O�����Դ��ǣ�Al��OH��3+OH���TAlO2��+2H2O��������������Һ����ͨ�����������̼��������ӦAlO2��+CO2+2H2O=Al��OH��3��+HCO3�� �� �ټ������ϡ���ᣬAl��OH��3+3HCl=AlCl3+3H2O��HCO3��+H+=CO2��+H2O����Ӧ������ͨ��CO2�����а�ɫ�������ɣ�������������������������ܽ⣬
���Դ��ǣ�ͨ��CO2�����а�ɫ�������ɣ�������������������������ܽ⣻��2����װ���в������ֶ�����̼�����ܱ���ȫ���գ����²ⶨ��̼�ᱵ������ƫС����������ͨ�����������Ϊ�������ɵ�CO2����ȫ������C�У�ʹ֮��ȫ��Ba��OH��2��Һ���գ�
���Դ��ǣ������ɵ�CO2����ȫ������C�У�ʹ֮��ȫ��Ba��OH��2��Һ���գ��ڶ�����̼������������Ӧ����̼�ᱵ��ˮ����Ӧ�����ӷ���ʽΪ��CO2+Ba2++2OH���TBaCO3��+H2O��
���Դ��ǣ�CO2+Ba2++2OH���TBaCO3��+H2O����a���ڼ�������֮ǰ��Ӧ�ž�װ���ڵ�CO2���壬��ֹӰ��̼�ᱵ�����IJⶨ��������߲ⶨȷ�ȣ���a�����ϣ�
b���μ��������CO2 �� CO2�����������գ����ų�װ��C���μ�����˹��죬ʹ������̼������ȫ��������߲ⶨȷ�ȣ���b�����ϣ�
c����AB֮������ʢ��Ũ�����ϴ��װ�ã�����ˮ�֣���Ӱ��CO2 �� ���������߲ⶨȷ�ȣ���c���ϣ�
d����BC֮������ʢ�б���̼��������Һ��ϴ��װ��Ba��OH��2 �� ��������CO2�е�HCl��Ӱ��CO2 �� ������߲ⶨȷ�ȣ���d���ϣ�
��ѡ��cd��
���Դ��ǣ�cd���ܣ�BaCO3����Ϊ3.94g����n��BaCO3��= ![]() =0.02mol����n��CaCO3��=0.02mol������Ϊ0.02mol��100g/mol=2g��������Ʒ��̼��Ƶ���������Ϊ
=0.02mol����n��CaCO3��=0.02mol������Ϊ0.02mol��100g/mol=2g��������Ʒ��̼��Ƶ���������Ϊ ![]() ��100%=25%��
��100%=25%��
���Դ��ǣ�25%��