题目内容
【题目】第19届亚洲运动会将于2022年在杭州举行,杭州的空气与水质量的提高越来越成为人们关注的问题。其中,烟气中的NOx与水中总氮含量(包括有机氮及NO3-、NO2-、NH4+等无机氮)都必须脱除(即脱硝)后才能排放。请回答下列问题:
I.空气的脱硝处理:
已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1= -890.3.kJ· mol-1
N2(g)+O2(g)=2NO(g) ΔH2= +180.kJ· mol-1
(1)CH4可用于脱硝,其化学方程式为CH4(g)+4NO(g)![]() CO2(g)+2N2(g)+2H2O(l),ΔH=____kJ· mol-1。在恒温,恒容的密闭容器中通入2mol CH4和4mol NO,下列说法正确的是____。
CO2(g)+2N2(g)+2H2O(l),ΔH=____kJ· mol-1。在恒温,恒容的密闭容器中通入2mol CH4和4mol NO,下列说法正确的是____。
A.甲烷过量,可将NO完全转化为N2
B.从反应开始到平衡的过程中,NO的转化率一直增大
C.反应过程中,容器中的压强保持不变
D.平衡后,再通入一定量的甲烷,正反应速率增大
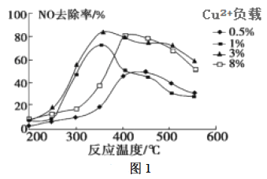
(2)C2H4也可用于烟气脱硝。为研究温度、催化剂中Cu2+负载量对其NO去除率的影响,控制其他条件一定,实验结果如图1所示。为达到最高的NO去除率,应选择的反应温度和Cu2+负载量分别是____。
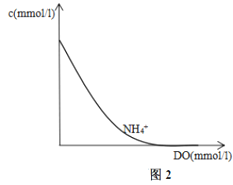
II.水的脱硝处理:
(3)水中的含氮物质在好氧硝化菌的作用下有如下反应:
2NH4+(aq)+3O2(g)=2NO2-(aq)+4H+(aq)+2H2O(l)(快反应)
2NO2-(aq)+O2(g)=2NO3-(aq)(慢反应)
20℃时含氮废水(以NH4+)的NH4+的浓度随DO(水体中溶解氧)浓度的变化曲线如图2所示,在图2上画出20℃时NO2-的浓度随DO的变化趋势图。_______
(4)研究表明,用电解法除去氨氮废水(反应中视为NH4+)有很高的脱氮(转化为N2)效率,写出该过程中阳极的电极反应式____。
【答案】-1250.3 BD 3%、350℃左右 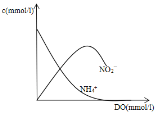 2NH4+-6e-=N2+8H+
2NH4+-6e-=N2+8H+
【解析】
(1)根据盖斯定律分析解答;A.可逆反应中反应物不能完全转化为生成物;B.从反应开始到平衡的过程中,NO的物质的量一直在减少;C.反应过程中,气体总物质的量减少;D.再通入一定量的甲烷,反应物浓度增大;
(2)根据图像找出NO去除率最高时对应的温度和催化剂中Cu2+负载量;
(3)由题给信息可知,生成NO2-的反应较快,后逐渐被氧化生成NO3-,NO2-浓度先增大后减小;
(4)阳极发生氧化反应,NH4+被氧化生成氮气。
I.(1)根据盖斯定律求解,CH4(g)+2O2(g)═CO2(g)+2H2O(l) △H= -890.3kJmol-1①;N2(g)+O2(g)═2NO(g) △H= +180kJmol-1②;CH4(g)+4NO(g)═CO2(g)+2N2(g)+2H2O(l) △H3③;则③=①-②×2,△H3=△H1-2△H2= -890.3-2×(+180)=-1250.3kJ;
A.可逆反应中反应物不能完全转化为生成物,所以NO不能完全反应,故A错误;B.从反应开始到平衡的过程中,NO的物质的量一直在减少,则NO转化率一直增大,故B正确;
C.反应过程中,气体总物质的量减少,气体压强与物质的量成正比,所以压强减小,故C错误;
D.平衡后,再通入一定量的甲烷,反应物浓度增大,浓度越大,反应速率越快,则正反应速率加快,故D正确;故选BD;
(2)由图1可知在350℃左右,催化剂中Cu2+负载量为3%时,NO去除率最高;
(3)由题给信息可知,生成NO2-的反应较快,后逐渐被氧化生成NO3-,NO2-浓度先增大后减小,则图像为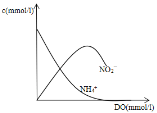 ;
;
(4)阳极发生氧化反应,NH4+被氧化生成氮气,电极方程式为2NH4+-6e-=N2+8H+。