题目内容
HA和HB两种酸的溶液分别加水稀释时,pH变化的简图如图所示,下列叙述中不正确的是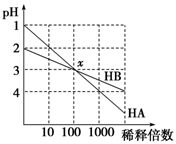
| A.HA是一种强酸 |
| B.x点,[A-]=[B-] |
| C.HB是一种弱酸 |
| D.原溶液中HA的物质的量浓度为HB的10倍 |
D
解析试题分析:A、根据图像可知HA稀释前pH=1,稀释100倍后pH=3,这说明在稀释过程中氢离子的物质的量不变,因此HA是强酸,A正确;B、x点两种溶液的pH相等,则根据电荷守恒可知[H+]=[OH-]+[A-]、[H+]=[OH-]+[B-],所以x点,[A-]=[B-],B正确;C、稀释前HB的pH=2,稀释100后pH=3,这说明在稀释过程中溶液中氢离子的物质的量是增加的,因此溶液中存在电离平衡,所以HB是弱酸,C正确;D、稀释前HA的浓度是0.1mol/L。但由于HB是弱酸,不能确定HB的浓度,所以无法计算原溶液中HA的物质的量浓度与HB的物质的量浓度关系,D不正确,答案选D。
考点:考查酸的稀释、弱酸的电离平衡以及图像分析等

 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案下列说法正确的是
| A.0.1 mol/L溶液中的(NH4)2SO4,溶液中的c(NH4+)<c(SO42-) |
| B.相同温度下,0.6 mol/L氨水溶液与0.3 mol/l氨水溶液中c(OH-)之比是2:1 |
| C.向0.1 mol/LNaNO3溶液中滴加硝酸使溶液pH=5,此时混合液中的c(Na+)<c(NO3-) |
| D.向醋酸钠溶液中加入适量醋酸,使混合液的pH=7,此时混合液中c(Na+)<c(CH3COO-) |
已知某温度下,几种酸的电离常数如下:Ka(HCN)= 6.2×10-10 mol/L、Ka(HF)= 6.8×10-4 mol/L、Ka(CH3COOH)= 1.8×10-5 mol/L、Ka(HNO2)= 6.4×10-6mol/L。则物质的量浓度都为0.1 mol/L的下列溶液中,pH最小的是
| A.NaCN | B.NaF | C.CH3COONa | D.NaNO2 |
某温度下,已知Ksp(BaSO4 )= 1.1×10-10,Ksp(BaCO3)=2.5×10-9。下列说法正确的是
| A.BaSO4比BaCO3溶解度小,所以,BaCO3 不可能转化为BaSO4 |
| B.BaCO3、BaSO4均不溶于水,所以都可以做钡餐试剂 |
| C.任何温度下,向Na2CO3溶液中加入BaCl2和Na2SO4,当两种沉淀共存时,c(SO42—)/ c(CO32—) =4.4×10-2 |
| D.该温度下,BaCO3若要在Na2SO4溶液中转化为BaSO4,则Na2SO4浓度至少为2.2×10-6 mol·L |
99℃时,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2,下列叙述不正确的是
| A.此时水的离子积Kw=1×10-12 | B.水电离出的c(H+)=1×10-12 mol/L |
| C.水的电离程度随温度升高而增大 | D.c(Na+)=c(SO42-) |
盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是
| A.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO32-和OH- |
| B.NaHCO3溶液中:[H]++[H2CO3]=[OH-] |
| C.10 mL 0.10 mol·L-1 CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:[Na+]>[CH3COO-]>[OH-]>[H+] |
| D.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同 |
常温下,将少量水加入下列物质中,相关量变化正确的是
| A.AgCl悬浊液中 c(Cl-)变小 | B.0.1mol/LCH3COOH溶液中 c(H+)变小 |
| C.0.1mol/LNa2CO3 c(HCO3-)变大 | D.0.1mol/LNH4Cl溶液中 n(OH-)变小 |
已知温度T时水的离子积常数为KW。该温度下,将浓度为a mol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是( )
| A.a = b |
| B.混合溶液的pH = 7 |
C.混合溶液中,c(H+) = 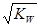 mol/L mol/L |
| D.混合溶液中,c(H+) + c(B-) = c(OH-) + c(A-) |
下列说法正确的是:
| A.已知某温度下纯水中的c(H+)=2×l0-7mol.L-1,据此无法求出水中c(OH-) |
| B.已知MgCO3的KSP=6.82×l0-6,则在含有固体MgCO3的MgCl2、Na2CO3溶液中,都有c(Mg2+) =c(CO32-),且c(Mg2+)·c(CO32-) = 6.82×10-6 mol2.L-2 |
C.常温下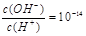 的溶液中存在Al3+、NH4+、Cl-、NO3- 的溶液中存在Al3+、NH4+、Cl-、NO3- |
| D.已知: |
| 共价键 | C—C | C=C | C—H | H—H |
| 键能/kJ·mol-1 | 348 | 610 | 413 | 436 |
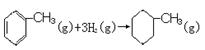 的焓变
的焓变