��Ŀ����
����˵����ȷ����
| A��0.1 mol/L��Һ�е�(NH4)2SO4����Һ�е�c(NH4��)��c(SO42��) |
| B����ͬ�¶��£�0.6 mol/L��ˮ��Һ��0.3 mol/l��ˮ��Һ��c(OH��)֮����2��1 |
| C����0.1 mol/LNaNO3��Һ�еμ�����ʹ��ҺpH=5����ʱ���Һ�е�c(Na��)��c(NO3��) |
| D�����������Һ�м����������ᣬʹ���Һ��pH=7,��ʱ���Һ��c(Na��)��c(CH3COO��) |
C
�������������A(NH4)2SO4="2" NH4++SO42-����������Һ��NH4+�ᷢ��ˮ�ⷴӦ����ˮ��ij̶��Ǻ������ܵ���˵c(SO42��)��c(NH4��)������B.�ڰ�ˮ�д��ڵ���ƽ��:NH3�� H2O  NH4��+ OH��.������ߵĵ���̶���ͬ�������ְ�ˮ�е�c(OH��)֮����2��1��������Һ��Ũ��Խ�� ������̶�ԽС����������������Һ��c(OH��)֮��С��2��1����������Na+ֻ��NaNO3�����������NO3������NaNO3��HNO3��ͬ������������Ի��Һ�е�c(Na��)��c(NO3��)����ȷ��D�����Һ��pH=7,��C(H+)=C(OH-)��������Һ�ʵ����Կ�֪C(H+)+c(Na��)=c(CH3COO��) +C(OH-)���ɵ�c(Na��)=c(CH3COO��)������
NH4��+ OH��.������ߵĵ���̶���ͬ�������ְ�ˮ�е�c(OH��)֮����2��1��������Һ��Ũ��Խ�� ������̶�ԽС����������������Һ��c(OH��)֮��С��2��1����������Na+ֻ��NaNO3�����������NO3������NaNO3��HNO3��ͬ������������Ի��Һ�е�c(Na��)��c(NO3��)����ȷ��D�����Һ��pH=7,��C(H+)=C(OH-)��������Һ�ʵ����Կ�֪C(H+)+c(Na��)=c(CH3COO��) +C(OH-)���ɵ�c(Na��)=c(CH3COO��)������
���㣺������Һ������Ũ�ȵĴ�С�Ƚϵ�֪ʶ��

 ��У����ϵ�д�
��У����ϵ�д���֪25��ʱ�й�����ĵ���ƽ�ⳣ����
| ���� | HCOOH | HCN | H2CO3 |
| ����ƽ�ⳣ�� | 1.77��l0�C5 | 4.9��l0�C10 | Ki1=4.3��l0�C7 Ki2=5.6��l0�C11 |
����ѡ��������
A�������ʵ���Ũ�ȵĸ���ҺpH��ϵΪ��PH��NaCN����PH��Na2CO3����PH��NaHCO3����PH��HCOONa��
B��2CN�C +H2O + CO2 ��HCN + CO32�C
C�������ʵ���Ũ�ȵ�HCN��Һ��NaOH��Һ�������Ϻ���Һ�У�c��OH�C����c��H+����c��Na+����c��CN�C��
D��NaHCO3��Na2CO3���Һ�У�һ����c��Na+��+ c��H+��=c��OH�C��+ c��HCO3�C�� +2c��CO32�C��
�����£���20.00mL 0.1000 mol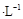 (NH4)2 SO4��Һ����μ���0.2000 mol
(NH4)2 SO4��Һ����μ���0.2000 mol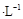 NaOHʱ����Һ��pH������NaOH��Һ����Ĺ�ϵ����ͼ��ʾ�������ǻӷ�����
NaOHʱ����Һ��pH������NaOH��Һ����Ĺ�ϵ����ͼ��ʾ�������ǻӷ�����
����˵����ȷ����
| A����a��ʾ��Һ�У�c(NH4+)��c(SO42-)��c(H+)��c(OH��) |
| B����b��ʾ��Һ�У�c(NH4+)��c(Na��)��c(H��)��c(OH��) |
| C����c��ʾ��Һ�У�c(SO42)+ c(H+)�� c(NH3��H2O )+ c(OH��) |
| D����d��ʾ��Һ�У�c(SO42)��c(NH3��H2O )��c(OH��)��c(NH4+) |
�����£����и����ֵΪ1��2���ǣ� ��
| A��0.1 mol��L��0.2 mol��L������Һ��c (H+)֮�� |
| B��0.1 mol/L NaHCO3��Һ��c(HCO3��)��c(Na+)֮�� |
| C��pH=10��Ba(OH)2��Һ�백ˮ�����ʵ����ʵ���Ũ��֮�� |
| D��pH=3�������������Һ��c(SO42��)��c(CH3COO��)֮�� |
������(SrSO4)��ˮ�еij����ܽ�ƽ���������£�����˵����ȷ����
| A���¶�һ��ʱ��Ksp(SrSO4)��c(SO42��)���������С |
| B��������ͬ�¶��У�363KʱKsp(SrSO4)��� |
| C��283Kʱ��ͼ��a���Ӧ����Һ�Dz�������Һ |
| D��283K�µ�SrSO4������Һ���µ�363K���Ϊ��������Һ |
����ˮ�����ص��������������ԣ������йص�˵������������� �ڰ�ˮ���� ��ǡ����ȫ��Ӧ ��c (NH4+) = c(Cl��) ��c (NH4+) �� c(Cl��) ��ȷ����
| A���ڢ� | B���ۢ� | C���ڢ� | D���٢� |
HA��HB���������Һ�ֱ��ˮϡ��ʱ��pH�仯�ļ�ͼ��ͼ��ʾ����������������ȷ����
| A��HA��һ��ǿ�� |
| B��x�㣬[A��]��[B��] |
| C��HB��һ������ |
| D��ԭ��Һ��HA�����ʵ���Ũ��ΪHB��10�� |
