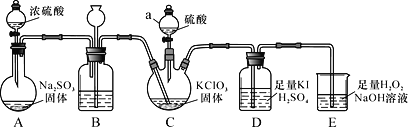
题目内容
【题目】(1)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:

①第一步反应是________(填“放热”或“吸热”)反应,判断依据是________________。
②1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是___________________________。
(2)已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ·mol-1①
Na2O2(s)+CO2(g)=Na2CO3(s)+0.5O2(g) ΔH=-226kJ·mol-1②
则CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数目为________________。
(3)已知H2(g)+Br2(l)=2HBr(g) ΔH=-72kJ·mol-1,蒸发1molBr2(l)需要吸收的能量为30kJ,其他相关数据如下表:
物质 | H2(g) | Br2(g) | HBr(g) |
1mol分子中的化学键断裂时需要吸收的能量(kJ) | 436 | 200 | a |
则表中a=______________。
【答案】放热 ΔH<0(或反应物的总能量大于生成物的总能量) NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l) ΔH=-346kJ·mol-1 2NA(或1.204×1024) 369
【解析】
本题主要考查热化学方程式的分析与计算。
(1)ΔH<0,则反应为放热反应,根据盖斯定律第一步+第二步即为总的热化学方程式。
(2)根据盖斯定律可知①+2×②即为所求热化学方程式,再根据得失电子计算电子转移数目。
(3)化学反应的焓变等于反应物的总键能-生成物的总键能。
(1)由图可知ΔH<0,则反应为放热反应,根据盖斯定律可知![]() ①
①
![]() ②;根据盖斯定律可知:①+②可得:NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l) ΔH=-346kJ·mol-1;
②;根据盖斯定律可知:①+②可得:NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l) ΔH=-346kJ·mol-1;
故答案为:放热;ΔH<0(或反应物的总能量大于生成物的总能量);NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l) ΔH=-346kJ·mol-1;
(2)2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ·mol-1①;Na2O2(s)+CO2(g)=Na2CO3(s)+0.5O2(g) ΔH=-226kJ·mol-1②;根据盖斯定律可知:①+2×②得:![]() ,当反应放出509kJ热量时有1molCO参与反应,电子转移数目为2NA(或1.204×1024);
,当反应放出509kJ热量时有1molCO参与反应,电子转移数目为2NA(或1.204×1024);
故答案为:NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l) ΔH=-346kJ·mol-1;2NA(或1.204×1024);
(3)H2(g)+Br2(l)=2HBr(g)ΔH=-72kJ·mol-1①蒸发1molBr2(l)需要吸收的能量为30kJ,Br2(l)= Br2(g) ΔH=30kJ·mol-1②,①-②得H2(g)+Br2(g)=2HBr(g) ΔH=-102kJ·mol-1,化学反应的焓变等于反应物的总键能-生成物的总键能,由表可知200+436-2a=-102,解得a=369;
故答案为:369。