题目内容
3.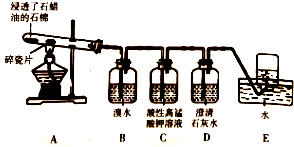 某同学设计实验探究工业制乙烯原理和乙烯的主要化学性质,实验装置如图所示:
某同学设计实验探究工业制乙烯原理和乙烯的主要化学性质,实验装置如图所示:(1)工业制乙烯的实验原理是,烷烃(液态)在催化剂和加热条件下发生反应生成不饱和烃,例如,石油分馏产物之一的十六烷烃发生如下反应(反应式已配平):
C16H34$→_{△}^{催化剂}$C8H18+甲;甲$→_{△}^{催化剂}$4乙
甲的分子式为C8H16;有42g乙加聚而成的高分子化合物的质量是42g.
(2)写出B装置中反应化学方程式:CH2=CH2+Br2→CH2Br-CH2Br;
(3)查阅资料得知,乙烯与酸性高锰酸钾溶液反应生成二氧化碳,写出开始时D装置中发生反应的离子方程式是Ca2++2OH-+CO2=CaCO3↓+H2O.
(4)为了探究溴与乙烯反应是加成反应而不是取代反应,可以测定B装置里溶液反应前后的酸性强弱,简述理由:乙烯与溴若发生取代反应,则必然生成溴化氢,溴化氢溶于水显酸性;
(5)除去甲烷中乙烯的方法是B(填序号).
A.将气体通和装水的洗气瓶中 B.将气体通过装溴水的洗气瓶中
C.将气体通过装酸性KMnO4溶液的洗气瓶中 D.将气体通过装NaOH溶液的洗气瓶中.
分析 石油裂化属于化学反应,遵循原子个数守恒,C16H34$→_{△}^{催化剂}$C8H18+甲,所以甲分子式为:C8H16;依据方程式:C8H16$→_{△}^{催化剂}$4乙,结合原子个数守恒可知,乙为:C2H4,根据实验装置图可知,A中产生的乙烯与B中的溴水发生加成反应,使溴水退色,乙烯被高锰酸钾溶液氧化生成二氧化碳,C中溶液也退色,生成的二气氧化碳使D中的澄清石灰水变浑,装置最后多余的乙烯可以用排水法收集,
(1)依据原子个数守恒判断甲、乙物质,根据元素守恒进行计算;
(2)乙烯含有碳碳双键,能够与溴发生加成反应;
(3)二氧化碳与氢氧化钙反应生成碳酸钙沉淀;
(4)乙烯与溴若发生取代反应,则必然生成溴化氢,溴化氢溶于水显酸性;
(5)甲烷性质稳定,乙烯含有C=C双键,能发生加成反应和氧化反应,可用溴水除杂,注意除杂时不能引入新的杂质.
解答 解:石油裂化属于化学反应,遵循原子个数守恒,C16H34$→_{△}^{催化剂}$C8H18+甲,所以甲分子式为:C8H16;依据方程式:C8H16$→_{△}^{催化剂}$4乙,结合原子个数守恒可知,乙为:C2H4,根据实验装置图可知,A中产生的乙烯与B中的溴水发生加成反应,使溴水退色,乙烯被高锰酸钾溶液氧化生成二氧化碳,C中溶液也退色,生成的二气氧化碳使D中的澄清石灰水变浑,装置最后多余的乙烯可以用排水法收集,
(1)根据上面的分析可知,甲分子式为:C8H16,乙烯发生加聚反应,总质量不变,所以42g乙烯加聚而成的高分子化合物的质量是42g;
故答案为:C8H16;42;
(2)乙烯含有碳碳双键,能够与溴发生加成反应而使溴水褪色,方程式为:CH2=CH2+Br2→CH3Br-CH3Br,
故答案为:CH2=CH2+Br2→CH2Br-CH2Br;
(3)乙烯与酸性高锰酸钾溶液反应产生二氧化碳,二氧化碳能够与氢氧化钙反应生成碳酸钙沉淀,反应的离子方程式为Ca2++2OH-+CO2=CaCO3↓+H2O,
故答案为:Ca2++2OH-+CO2=CaCO3↓+H2O;
(4)乙烯与溴若发生取代反应,则必然生成溴化氢,溴化氢溶于水显酸性;
故答案为:乙烯与溴若发生取代反应,则必然生成溴化氢,溴化氢溶于水显酸性;
(5)A.甲烷、乙烯不溶于水,且常温下与水都不反应,不能用于鉴别和除杂;
B.乙烯含有C=C双键,能与溴水发生加成反应生成二溴乙烷液体,甲烷不与溴水反应,所以可用溴水除去甲烷中混有的乙烯,可以鉴别甲烷与乙烯;
C.甲烷与高锰酸钾不反应,乙烯能够与高锰酸钾反应使其褪色,可以鉴别二者;但是乙烯被氧化生成和二氧化碳气体,不能用于除杂;
D.甲烷、乙烯都不溶于氢氧化钠溶液,不能用来鉴别和除杂;
故答案为:B.
点评 本题考查了乙烯的制备和性质的检验,熟悉裂化的原理及原子个数守恒规律、乙烯的性质是解题关键,题目难度不大.

| 品 名 | 火腿 |
| 配 料 | ①精选瘦肉 ②食盐 ③VC ④亚硝酸钠等 |
| 保质期 | 0℃~4℃30天 |
| 生产日期 | 见包装封口处 |
| A. | Al、Mg | B. | Al、Si | C. | Al、Cu、Mn、Si | D. | Al、Zn |
| A. | ①②③④ | B. | ②③④ | C. | ③④ | D. | ③ |
| A. | 某人的血糖检测结果为90mg/dL,他的血糖是正常(人的血糖正常值在3.61----6.11mmol/L,血糖相对分子质量180) | |
| B. | 用点燃的火柴在液化气钢瓶口检验是否漏气 | |
| C. | 当光束通过有尘埃的空气、氯化铁溶液、墨水等分散系能观察到丁达尔现象 | |
| D. | 胶体属于介稳体系原因是胶体带电 |
| A. | 84% | B. | 60% | C. | 91% | D. | 42% |
 工业烧碱成分NaOH、Na2CO3和可溶于水但不与酸反应的杂质,工业纯碱成分Na2CO3、NaHCO3和可溶于水但不与酸碱反应的杂质.为测定碱中各成分的百分含量可采用滴定法、气体法等.
工业烧碱成分NaOH、Na2CO3和可溶于水但不与酸反应的杂质,工业纯碱成分Na2CO3、NaHCO3和可溶于水但不与酸碱反应的杂质.为测定碱中各成分的百分含量可采用滴定法、气体法等.