题目内容
18.关于同温同压下等体积的NO2和NO的叙述:①质量相等;②密度相等;③所含分子数相等;④所含氮原子个数相等.其中正确的是( )| A. | ①②③④ | B. | ②③④ | C. | ③④ | D. | ③ |
分析 同温同压下等体积的NO2和NO的物质的量相同,则分子数相等,氮原子个数相等,根据物质的量和相对分子质量计算质量关系和密度关系.
解答 解:根据阿伏加德罗定律可知:NO2和NO的相对分子质量不同,相同物质的量时,二者质量不同,故①错误;
密度等于质量除以体积,质量不同,体积相同,则密度不同,故②错误;
同温同压下等体积的NO2和NO的物质的量相同,则分子数相等,氮原子个数相等,故③④正确.
故选C.
点评 本题考查物质的量的有关计算,以及阿伏加德罗定律及推论,题目难度不大,注意把握物质的量、质量、体积之间的计算公式的运用.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
9.常温下下列各组离子在给定条件下能大量共存的是( )
| A. | 在pH=1的溶液中:NH4+、K+、ClO-、Cl- | |
| B. | pH<7的溶液中:SO42-、CO32-、Na+、K+ | |
| C. | 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- | |
| D. | 在c(H+)=1.0×10-13 mol•L-1的溶液中:Na+、S2-、AlO2-、SO32- |
6.在元素周期表中,金属元素和非金属元素分界线附近能找到( )
| A. | 制半导体元素 | B. | 制农药元素 | ||
| C. | 制催化剂元素 | D. | 制耐高温合金的元素 |
3.在一密闭容器中充入H2和Br2(气)的混合气,发生H2(g)+Br2(g)═2HBr(g)+Q(Q>0),当达到平衡后,改变某一反应条件(混合气体的物质的量不变),容器内气体的压强增大,下列说法正确的是( )
| A. | 平衡可能向逆反应方向移动 | B. | 混合气体的密度一定增大 | ||
| C. | 容器内混合气体的颜色变浅 | D. | 正,逆反应速率一定加快 |
 利用反应2Fe3++Fe═3Fe2+,设计原电池如图所示.
利用反应2Fe3++Fe═3Fe2+,设计原电池如图所示.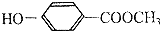 的同分异构体:
的同分异构体: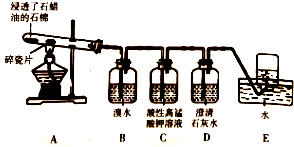 某同学设计实验探究工业制乙烯原理和乙烯的主要化学性质,实验装置如图所示:
某同学设计实验探究工业制乙烯原理和乙烯的主要化学性质,实验装置如图所示: