题目内容
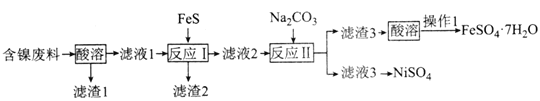
【题目】NiSO4是制备磁性材料和催化剂的重要中间体。用含镍废料(主要成分为NiO,含有少量CuO、FeO和SiO2)制备NiSO4并回收金属资源的流程如图:
下列说法错误的是( )
A.“酸溶”时应选用硫酸
B.滤渣2的成分为CuS和FeS
C.“操作1”为蒸发结晶
D.合理处理废弃物有利于保护环境和资源再利用
【答案】B
【解析】
含镍废料(主要成分为NiO,含有少量CuO、FeO和SiO2)加入硫酸酸溶,滤渣1为SiO2,滤液1含有NiSO4、CuSO4、FeSO4,加入FeS,可除去Cu2+,生成滤渣2含有CuS,滤液2加入碳酸钠,可生成碳酸亚铁,加入硫酸溶液可生成硫酸亚铁,蒸发结晶得到硫酸亚铁晶体,滤液3含有NiSO4,以此解答该题。
A.根据流程图分析最终目的是制备FeSO4·7H2O,为避免生成杂质,所以“酸溶”时应选用硫酸,A正确;
B.FeS可转化为溶解度更小的CuS,由于亚铁离子易被氧化,则滤液中可含有Fe3+,Fe3+氧化S2-生成S单质,则滤渣2的成分为CuS、FeS和S,B错误;
C.由溶液得到晶体,可用蒸发结晶的方法,C正确;
D.合理处理废弃物,可减少污染,有利于保护环境和资源再利用,D正确;
故合理选项是B。

练习册系列答案
相关题目