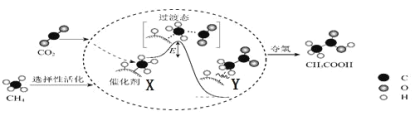
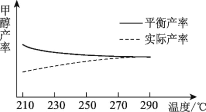
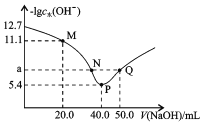
题目内容
【题目】已知:①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1;
②C(s)+O2(g)=CO2(g) ΔH2;
③2H2(g)+O2(g)=2H2O(l) ΔH3;
④2CO2(g)+4H2(g)=CH3COOH(l)+2H2O(l) ΔH4;
⑤2C(s)+2H2(g)+O2(g)=CH3COOH(l) ΔH5。
下列关于上述反应焓变的判断正确的是( )
A.ΔH1>0,ΔH2<0B.ΔH5=2ΔH2+ΔH3-ΔH1
C.ΔH1<0,ΔH3<0D.ΔH4=ΔH1-2ΔH3
【答案】BC
【解析】
A.物质的燃烧反应是放热反应,焓变小于零,即△H1<0、△H2<0,故A错误;
B.利用盖斯定律进行计算,将②![]() 2+③-①,可得⑤2C(s)+2H2(g)+O2(g)=CH3COOH(l) ΔH5=2ΔH2+ΔH3-ΔH1,故B正确;
2+③-①,可得⑤2C(s)+2H2(g)+O2(g)=CH3COOH(l) ΔH5=2ΔH2+ΔH3-ΔH1,故B正确;
C.物质的燃烧反应是放热反应,焓变小于零,所以ΔH1<0,ΔH3<0,故C正确;
D.根据盖斯定律:①-③![]() 2得到CH3COOH(l)+2H2O(l)=2CO2(g)+4H2(g),不是反应④,故D错误;
2得到CH3COOH(l)+2H2O(l)=2CO2(g)+4H2(g),不是反应④,故D错误;
故答案:BC。

练习册系列答案
相关题目