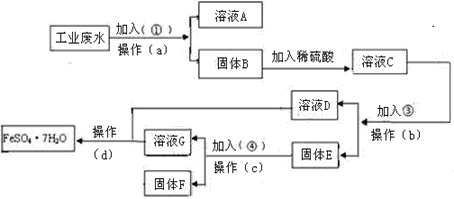
题目内容
【题目】现用氯气与氢氧化钠溶液反应,若耗用的氯气为4.48L(标准状况)。该反应方程式为:Cl2+2NaOH=NaCl+ NaClO+H2O
(1)则选用所贴标签为2.0mol·L—1的氢氧化钠,至少需该氢氧化钠溶液_____毫升。
(2)如选用所贴标签为10%(密度为1.043gmL—1)的盐酸中和上述反应中所消耗的氢氧化钠,至少需该盐酸________毫升(保留小数点后一位)。
【答案】200mL140.0mL
【解析】
4.48L标准状况下的氯气的物质的量是![]() ,根据化学方程式的系数比等于物质的量比计算需氢氧化钠溶液的体积;10%(密度为1.043gmL—1)的盐酸的物质的量浓度是
,根据化学方程式的系数比等于物质的量比计算需氢氧化钠溶液的体积;10%(密度为1.043gmL—1)的盐酸的物质的量浓度是![]() ,根据化学方程式计算盐酸的体积。
,根据化学方程式计算盐酸的体积。
(1)设需该氢氧化钠溶液的体积为xL
Cl2+ 2NaOH=NaCl+ NaClO+H2O
1mol 2mol
0.2mol 2.0mol·L—1![]()
![]()
x=0.2L=200mL。
(2)10%(密度为1.043gmL—1)的盐酸的物质的量浓度是![]() ,设中和上述反应中所消耗的氢氧化钠,至少需该盐酸yL;
,设中和上述反应中所消耗的氢氧化钠,至少需该盐酸yL;
NaOH + HCl = NaCl+ NaClO+H2O
1mol 1 mol
2.0mol·L—1![]()
![]()
![]()
y=0.14L=140mL。

【题目】某研究性学习小组的同学设计了如图装置制取溴苯和溴乙烷:
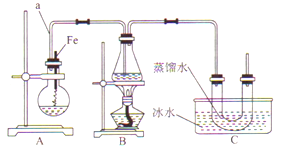
已知:乙醇在加热的条件下可与HBr反应得到溴乙烷(CH3CH2Br),二者某些物理性质如下表所示:
溶解性(本身均可作溶剂) | 沸点(℃) | 密度(g/mL) | |
乙醇 | 与水互溶,易溶于有机溶剂 | 78.5 | 0.8 |
溴乙烷 | 难溶于水,易溶于有机溶剂 | 38.4 | 1.4 |
请回答下列问题:
(1)B中发生反应生成目标产物的化学方程式为___________。
(2)根据实验目的,选择合适的实验步骤:①→____________。
①组装好装置,_________________(填写实验操作名称);
②将A装置中的纯铁丝小心向下插入苯和液溴的混合液中;
③点燃B装置中的酒精灯,用小火缓缓对锥形瓶加热10分钟;
④向烧瓶中加入一定量苯和液溴,向锥形瓶中加入无水乙醇至稍高于进气导管口处,向U形管中加入蒸馏水封住管底,向水槽中加人冰水。
(3)简述实验中用纯铁丝代替铁粉的优点:_________________。
(4)反应完毕后,U形管内的现象是_________;分离溴乙烷时所需的玻璃仪器是___________。
(5)假设最初取用的无水乙醇是71.9 mL,最后得到的纯净的溴乙烷是66.2 mL,则溴乙烷的产率为______________(保留两位小数)。