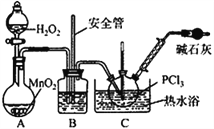
题目内容
【题目】25℃时在10mL0.1mol/LNa2CO3溶液中逐滴加入0.1mol/LHCl溶液,溶液中含碳微粒的物质的量分数随溶液pH的变化如下图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是
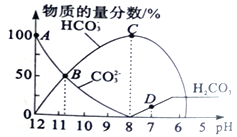
A. A点时,溶液中c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-)
B. B点时,溶液中c(Na+)>c(CO32-)=c(HCO3-)>(H+)>c(OH-)
C. C点时,溶液中浓度最大的离子是 Na+
D. D点时,溶液的pH为7,溶液的总体积为20mL
【答案】C
【解析】A、任何电解质溶液中都存在电荷守恒,阴阳离子所带电荷总数相同,A点所示的溶液c(Na+)+c(H+)=2(CO32-)+(HCO3-)+(OH-),故A错误;B、B点溶液呈碱性,c(Na+)>c(CO32-)=c(HCO3-)>c(OH-)>(H+),故B错误;C、C点时,溶液中主要是碳酸氢钠和氯化钠,溶液中浓度最大的离子是 Na+,故C正确;D、D点时,溶液的pH为7,加入0.1mol/LHCl溶液体积为20mL,故D错误;故选C。

练习册系列答案
相关题目