题目内容
【题目】Ⅰ.请将括号中的杂质去除,依次写出除杂试剂和实验方法
例:CO2(HCl):饱和NaHCO3溶液,洗气。
①甲烷(乙烯):___________________,________。
②水(碘):___________________,________。
③HBr(Br2):___________________,________。
④溴苯(Br2):___________________,________。
⑤乙醇(乙酸):___________________,________。
⑥乙酸乙酯(乙酸):___________________,________。
Ⅱ.乙酸异戊酯是组成蜜蜂信息素的成分之一,具有橡胶的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关信息如下:
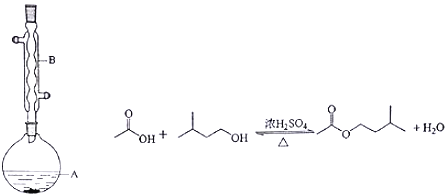
相对分子质量 | 沸点/℃ | 水中溶解度 | |
异戊醇 | 88 | 131 | 微溶 |
乙酸 | 60 | 118 | 溶 |
乙酸异戊酯 | 130 | 142 | 难溶 |
实验步骤:
在A中加入4.4g的异戊醇,6.0g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50分钟,反应液冷至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g.回答下列问题:
(1)装置B的名称是________________;
(2)在洗涤、分液操作中,应充分振荡,然后静置,待分层_________(填标号),
A.直接将乙酸异戊酯从分液漏斗上口倒出
C.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
B.直接将乙酸异戊酯从分液漏斗下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
(3)本实验中加入过量乙酸的目的是_________________;
(4)实验中加入少量无水硫酸镁的目的是_________________;
(5)本实验的产率是____________。
A.30% B.40% C.50% D.60%
【答案】Ⅰ.①溴水 洗气 ②苯或四氯化碳 萃取、分液 ③苯或四氯化碳 洗气 ④NaOH溶液 分液 ⑤烧碱 蒸馏 ⑥饱和碳酸钠溶液 分液
Ⅱ.(1)冷凝管
(2)d
(3)提高异戊醇的转化率
(4)干燥乙酸异戊酯
(5)D
【解析】
试题分析:Ⅰ.①乙烯与溴水反应,而甲烷不能,则选择试剂为溴水,分离方法为洗气;②加入苯或四氯化碳萃取后静置分液即可;③溴易溶于苯或四氯化碳,可通过苯或四氯化碳洗气即可;④溴与NaOH溶液反应后与溴苯分层,然后分液;⑤乙酸与NaOH反应后,增大与乙醇的沸点差异,则选择试剂为烧碱,分离方法为蒸馏;⑥乙酸与碳酸钠反应后与乙酸乙酯分层,然后分液;
Ⅱ.(1)由于异戊醇、乙酸都是易挥发的物质,为使反应能充分进行,要用冷凝管冷凝回流,装置B是冷凝管;
(2)由于酯的密度比水小,二者互不相溶,因此水在下层,酯在上层;分液时,要先将水层从分液漏斗的下口放出,待到两层液体界面时关闭分液漏斗的活塞,再将乙酸异戊酯从上口放出,所以正确的为d;
(3)酯化反应是可逆反应,增大反应物的浓度可以使平衡正向移动;增加一种反应物的浓度,可以使另一种反应物的转化率提高,因此本实验中加入过量乙酸的目的是提高提高异戊醇的转化率;
(4)实验中加入少量无水硫酸镁的目的是吸收酯中少量的水分,对其进行干燥;
(5)乙酸的物质的量为:n=![]() =0.1mol,异戊醇的物质的量为:n=
=0.1mol,异戊醇的物质的量为:n=![]() =0.05mol,由于乙酸和异戊醇是按照1:1进行反应,所以乙酸过量,生成乙酸异戊酯的量要按照异戊醇的物质的量计算,即理论上生成0.05mol乙酸异戊酯;实际上生成的乙酸异戊酯的物质的量为
=0.05mol,由于乙酸和异戊醇是按照1:1进行反应,所以乙酸过量,生成乙酸异戊酯的量要按照异戊醇的物质的量计算,即理论上生成0.05mol乙酸异戊酯;实际上生成的乙酸异戊酯的物质的量为![]() =0.03mol,所以实验中乙酸异戊酯的产率为
=0.03mol,所以实验中乙酸异戊酯的产率为![]() ×100%=60%,故答案为D。
×100%=60%,故答案为D。