题目内容
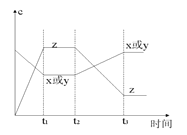
【题目】草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/LNaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
A. V(NaOH)=0时,c(H+)=1×10-2mol/L
B. V(NaOH)<10mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4-)
C. V(NaOH)=10mL时,c(H+)=1×10-7mol/L
D. V(NaOH)>10mL时,c(Na+)>c(C2O42-)>c(HC2O4-)
【答案】D
【解析】试题分析:草酸是二元中强酸,草酸氢钠溶液显酸性,这说明HC2O4-的水解程度小于HC2O4-的电离程度,但电离是不彻底的,所以溶液中氢离子的浓度小于0.01mol/L,A不正确;当V(NaOH)="=" 10 mL时,二者恰好反应时生成草酸钠,水解溶液显碱性。根据电荷守恒可知c(H+)+c(Na+)=" 2" c(C2O![]() )+ c(HC2O
)+ c(HC2O![]() )+c(OH-),如果V(NaOH)< 10 mL,则溶液就可能显中性,则c(H+)=c(OH-),所以c(Na+)="=" 2 c(C2O
)+c(OH-),如果V(NaOH)< 10 mL,则溶液就可能显中性,则c(H+)=c(OH-),所以c(Na+)="=" 2 c(C2O![]() )+ c(HC2O
)+ c(HC2O![]() ),即B、C都不正确,选项D正确,答案选D。
),即B、C都不正确,选项D正确,答案选D。

练习册系列答案
相关题目