题目内容
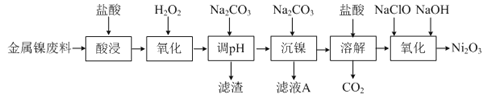
【题目】I、三氧化二镍(Ni2O3)是一种灰黑色无气味有光泽的块状物,易碎成细粉末,常用于制造高能电池。工业上以金属镍废料生产NiCl2,继而生产Ni2O3的工艺流程如下:
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |
(1)①为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有:适当升高温度,搅拌,______等。
②酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等。在沉镍前,需加Na2CO3控制溶液pH范围为______。
(2)“氧化”生成Ni2O3的离子方程式为______。
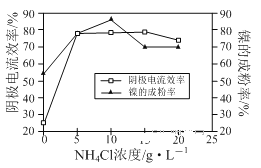
(3)工业上用镍为阳极,电解0.05 ~ 0.1 mol·L-1 NiCl2 溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉。当其它条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如下图所示,则NH4Cl的浓度最好控制为______。
II、煤制天然气的工艺流程简图如下:
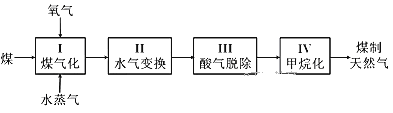
(4)已知反应I:C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=+135 kJ·mol-1,通入的氧气会与部分碳发生燃烧反应。请利用能量转化及平衡移动原理说明通入氧气的作用:______。
CO(g)+H2(g) ΔH=+135 kJ·mol-1,通入的氧气会与部分碳发生燃烧反应。请利用能量转化及平衡移动原理说明通入氧气的作用:______。
(5)①甲烷化反应IV发生之前需要进行脱酸反应III。煤经反应I和II后的气体中含有两种酸性气体,分别是H2S和_____。
②工业上常用热碳酸钾溶液脱除H2S气体得到两种酸式盐,该反应的离子方程式是____。
(6)一定条件下,向体积为2L的恒容密闭容器中充入1.2 mol CH4(g)和4.8 mol CO2(g),发生反应:CH4 (g)+3CO2 (g)![]() 2H2O(g)+4CO(g) ΔH>0。实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如右图。计算该条件下,此反应的
2H2O(g)+4CO(g) ΔH>0。实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如右图。计算该条件下,此反应的![]() H=______。
H=______。

【答案】 增大盐酸的浓度(或将镍废料研成粉末等) 4.7≤pH<7.1 2Ni2++ClO-+4OH-=== Ni2O3↓+Cl-+2H2O 10 g·L-1 氧气与碳发生燃烧反应放热,放出的热被可逆反应吸收利用,促进反应正向移动 CO2 CO32-+H2S![]() HS-+HCO3- +330 kJ·mol-
HS-+HCO3- +330 kJ·mol-
【解析】试题分析:I、(1)①根据影响反应速率的因素回答;②根据相关金属离子开始生成氢氧化物沉淀和完全生成沉淀的pH,要让Fe2+、Fe3+、Al3+等沉淀而Ni2+不生成沉淀,需要将Fe2+氧化为Fe3+,再调节PH。(2)根据得失电子守恒配平次氯酸钠氧化Ni2+的离子方程式;(3)NH4Cl的浓度最好控制在镍的成粉率最高点;II、(4)C(s)+H2O(g)![]() CO(g)+H2(g)反应吸热,氧气会与部分碳发生燃烧反应放热;(5)①根据元素守恒,煤经反应I和II后的气体中含有两种酸性气体,分别是H2S和CO2;②热碳酸钾溶液与H2S气体得到两种酸式盐是碳酸氢钠和硫氢化钠;(6)根据图像可知,吸收118.8 kJ能量时CH4的体积分数为
CO(g)+H2(g)反应吸热,氧气会与部分碳发生燃烧反应放热;(5)①根据元素守恒,煤经反应I和II后的气体中含有两种酸性气体,分别是H2S和CO2;②热碳酸钾溶液与H2S气体得到两种酸式盐是碳酸氢钠和硫氢化钠;(6)根据图像可知,吸收118.8 kJ能量时CH4的体积分数为![]() ,利用“三段式”计算消耗甲烷的物质的量。
,利用“三段式”计算消耗甲烷的物质的量。
解析:I、(1)(1)①为了提高金属镍废料浸出的速率,可采取的措施有:适当升高温度,搅拌,增大盐酸的浓度等;②要让Fe2+、Fe3+、Al3+等沉淀而Ni2+不生成沉淀,需要将Fe2+氧化为Fe3+,再调节PH,使Fe3+、Al3+等完全沉淀PH≥4.7,Ni2+不生成沉淀PH<7.1,所以控制PH的范围是4.7≤pH<7.1。(2)根据得失电子守恒配平次氯酸钠氧化Ni2+的离子方程式是2Ni2++ClO-+4OH-=== Ni2O3↓+Cl-+2H2O;(3)NH4Cl的浓度最好控制在镍的成粉率最高点,所以NH4Cl的浓度最好控制在10 g·L-1;II、(4)C(s)+H2O(g)![]() CO(g)+H2(g)反应吸热,氧气会与部分碳发生燃烧反应放热,氧气与碳发生燃烧放出的热被C(s)+H2O(g)
CO(g)+H2(g)反应吸热,氧气会与部分碳发生燃烧反应放热,氧气与碳发生燃烧放出的热被C(s)+H2O(g)![]() CO(g)+H2(g)吸收利用,促进反应正向移动;(5)①根据元素守恒,煤经反应I和II后的气体中含有两种酸性气体,分别是H2S和CO2;②热碳酸钾溶液与H2S气体得到两种酸式盐是碳酸氢钠和硫氢化钠,反应离子方程式是CO32-+H2S
CO(g)+H2(g)吸收利用,促进反应正向移动;(5)①根据元素守恒,煤经反应I和II后的气体中含有两种酸性气体,分别是H2S和CO2;②热碳酸钾溶液与H2S气体得到两种酸式盐是碳酸氢钠和硫氢化钠,反应离子方程式是CO32-+H2S![]() HS-+HCO3-;
HS-+HCO3-;
(6)设参加反应的甲烷的物质的量为xmol;
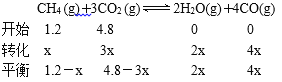
![]()
x=0.36mol
根据图像可知,0.36mol甲烷参加反应吸收118.8 kJ能量,则1mol甲烷反应吸收热量118.8 kJ÷0.36=330 kJ,所以此反应的![]() H=+330 kJ·mol-1。
H=+330 kJ·mol-1。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案