题目内容
【题目】无机研究开创绝不无“钴”的时代,例如:CoCl2·6H2O是一种饲料营养强化剂、草酸钴可用于指示剂和催化剂。其中草酸钴的制备可用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2等)制取CoC2O4·2H2O工艺流程如下图所示:

已知:
①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②酸性条件下,ClO3-不会氧化Co2+,ClO3-转化为Cl-;
(1)浸出过程中加入Na2SO3的主要离子方程式为____________________。
(2)加入 NaClO3发生可以将溶液中Fe2+氧化,进而调节pH除去,但不能向“浸出液”中加过量 NaClO3的主要原因是:__________________。
(3)若“滤液Ⅰ”中c(Ca2+)=1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-)=___________mol/L。[已知Ksp(CaF2)=4.0×10-11]
(4)萃取剂对金属离子的萃取率与pH的关系如图1所示,萃取剂的选择的标准是___________;其使用的适宜pH范围是___________(填字母代号)。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5

(5)CoC2O4·2H2O热分解质量变化过程如图2所示。其中600℃以前是隔绝空气加热,600℃以后是在空气中加热。A、B、C均为纯净物;用化学方程式表示从A点到B点的物质转化___________。C点所示产物的化学式是___________。(Co的相对原子质量是59)
【答案】Co2O3+4H++SO32-== 2Co2++SO42-+2H2O 过量的ClO3-在酸性条件下会与Cl-反应生成氯气。既增加试剂使用,又产生污染。 2.0×10-3mol·L-1 不与水互溶,不与水、Co2+反应,相同条件下杂质离子在萃取剂中溶解度大而Co2+在萃取剂中溶解度小。 b CoC2O4=350℃=Co+2CO2 Co2O3
【解析】
(3) 利用Ksp计算即可;
(4) 从选取萃取剂的标准考虑;
(1) 水钴矿主要成分为Co2O3,而浸出液中的是Co2+,钴的化合价降低为氧化剂,而Na2SO3为还原剂,Na2SO3主要与Co3+反应,本题要求写出主要反应并不需要写Na2SO3与Fe3+的反应,答案为Co2O3+4H++SO32-== 2Co2++SO42-+2H2O;
(2) ClO3-过量使用会带来新的杂质,才会和氯离子发生反应生成氯气,答案过量的ClO3-在酸性条件下会与Cl-反应生成氯气。既增加试剂使用,又产生污染;
(3) c(Ca2+)=1.0×10-3mol·L-1,当除钙率达到99%时,则剩余c(Ca2+)=1.0×10-5mol·L-1,根据![]() ,则
,则![]() ,答案为2.0×10-3mol/L;
,答案为2.0×10-3mol/L;
(4) 按照萃取剂的选择标准,它不能和原溶剂发生反应,不会和溶质发生反应,而且溶质在萃取剂中的溶解度大于在原溶剂中的溶解度;该过程中萃取剂的作用是将Fe2+、Mn2+、Al3+除去,而不去除Co2+,根据图像可知适宜的pH,答案为不与水互溶,不与水、Co2+反应,相同条件下杂质离子在萃取剂中溶解度大而Co2+在萃取剂中溶解度小;b;
(5)18.30g的CoC2O4·2H2O,为0.1mol,A到B的过程质量减少3.6g,为0.2molH2O,A为CoC2O4,B到C的过程中,质量减少8.8g,只能为0.2molCO2的质量,B处的为Co单质,可以写出反应方程式,B到C在空气中加热,生成Co的氧化物,0.1mol的Co质量为5.9g,剩余2.4g为O的质量,0.15mol,则产物为Co2O3。答案为CoC2O4 ![]() Co+2CO2,Co2O3。
Co+2CO2,Co2O3。

【题目】向2 L的恒容密闭容器中通入气体X和Y,发生反应X(g)+Y(g)![]() Z(g) ΔH,所得实验数据如下表:
Z(g) ΔH,所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | 达到平衡的时间/min | |
n(X) | n(Y) | n(Z) | |||
① | 400 | 4.0 | 3.0 | 2.0 | 2 |
② | 500 | 4.0 | 3.0 | 1.0 | 1 |
③ | 500 | 4.0 | 1.0 | ||
下列说法不正确的是
A. 该反应正反应为放热反应
B. ①中,0-2min内,用Y表示的平均反应速率υ (Y)=1 mol/(L·min)
C. ③中,达到平衡时,该反应的平衡常数K=![]()
D. ③中,达到平衡时,n(Z)<1.0 mol
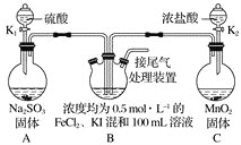
【题目】化学课上,同学们利用下列实验探究碱的化学性质:

(1)A实验中观察到的现象是_______。
(2)B实验中发生的离子反应方程式是_____。
(3)C实验中发生的离子反应方程式是____。
(4)实验结束后,同学们将废液倒入同一只废液缸中,最后发现废液浑浊并显红色。
(提出问题)废液中含有什么物质?
(假设猜想)通过分析,同学们猜想:废液中除酚酞、碳酸钙及水以外一定含有_____。
老师问:废液中还可能有什么物质?引发了同学们热烈讨论,下面是大家的发言:
学生甲 | 可能有CaCl2、Na2CO3 | 学生丙 | 可能有Ca(OH)2、CaCl2 |
学生乙 | 可能有NaOH、Na2CO3 | 学生丁 | 可能有Na2CO3 |
学生戊 | 可能有NaOH | … | … |
上述几位学生的猜想中,有一种明显不合理,你认为谁的猜想不合理?并说明理由。_____
(实验验证)同学们对可能含有的物质进行确定,取一定量的废液过滤,向滤液中逐滴加入氯化钡溶液,得到白色沉淀,红色褪去。
(结论)上述废液中,还含有____,没有_____。