题目内容
【题目】下列物质中,不属于合金的是()
A.硬铝B.黄铜C.不锈钢D.水银
【答案】D
【解析】
A.硬铝是指铝合金中以Cu为主要合金元素的(含2.2-4.9%Cu、0.2-1.8%Mg、0.3-0.9%Mn、少量的硅,其余部分是铝)一类铝合金,故A不符合题意;
B.黄铜是铜和锌的合金,故B不符合题意;
C.不锈钢是钢的一种,一般Cr(铬)含量至少为10.5%,还含有Ni、Ti、Mn、Nb、Mo、Si、Cu等元素,属于合金,故C不符合题意;
D.水银为汞单质,不是合金,故D符合题意;
答案选D。

【题目】浓氨水可用于检验氨气的泄漏,文献表明一定条件下NH3与C12可发生置换反应,某同学在实验室中对NH3与Cl2反应进行了探究。回答下列题:
(1)氯气的制备
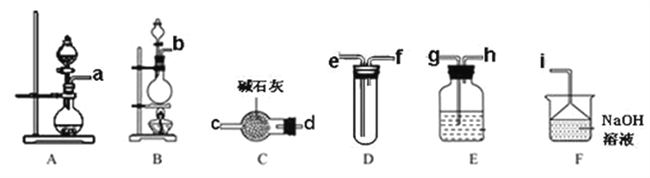
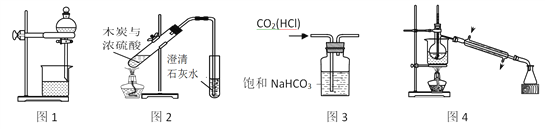
①氯气的发生装置可以选择上图中的_______(填装置编号),反应的化学方程式为________。
②欲收集一瓶干燥、纯净氯气,选择上图中的装置部分装置可以重复使用,E装置中试剂可根据需要改变),其连接顺序为:发生装置→___按气流方向,用小写字母表示)。
(2)NH3与Cl2的反应
将上述收集到的Cl2连接在右图Y中,在注射器X中充入NH3(中间连接管用夹子K夹好)。按图示装置进行实验。
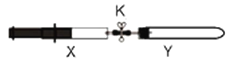
操作步骤 | 实验现象 | 解释原因 |
打开K,推动注射器活塞,使少量NH3非常缓慢充入Y管中 | ①y管中.没有出现明显的白烟 | ②反应的化学方程式_____________ |
继续较快通入NH3 | Y管中产生较多白烟 | ③产生白烟的化学方程式_____________。 |
(3)实验设计:
①设计实验证明白烟所含物质中的阳离子__________。
②用(2)中装置设计实验证明氯元素比硫元索非金属性强__________。
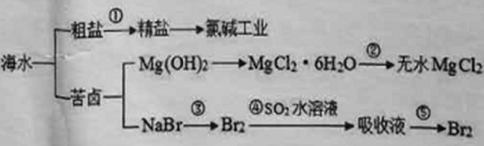
【题目】冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。请回答下列问题:

(1)Ti的原子序数为22,Ti位于元素周期表中第_______周期。
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式_______________。
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2·x H2O,再经焙烧制得。水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因:_________________________________________。
(4)由TiCl4→Ti 需要在Ar气中进行的理由是_________________________________。反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于___________℃即可。
TiCl4 | Mg | MgCl2 | Ti | |
熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
(5)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+ ,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取TiO2(摩尔质量为M g/mol)试样w g,消耗c mol/L NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数为___________________。(用代数式表示)
(6)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g) ![]() CH3OH(g)。若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2 ____mol。
CH3OH(g)。若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2 ____mol。
【题目】ZrO2常用作陶瓷材料,可由锆英砂(主要成分为ZrSiO4,也可表示为ZrO2·SiO2,还含少量Fe2O3、Al2O3、SiO2等杂质)通过如下方法制取:

已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+。
②部分金属离子在实验条件下开始沉淀和完全沉淀的pH如下表。
金属离子 | Fe3+ | Al3+ | ZrO2+ |
开始沉淀时pH | 1.9 | 3.3 | 6.2 |
沉淀完全时pH | 3.2 | 5.2 | 8.0 |
(1)熔融时ZrSiO4发生反应的化学方程式为 ,滤渣I的化学式为 。
(2)为使滤液I的杂质离子沉淀完全,需用氨水调pH=a,则a的范围是 ;继续加氨水至pH=b时,所发生反应的离子方程式为 。
(3)向过滤III所得滤液中加入CaCO3粉末并加热,得到两种气体。该反应的离子方程式为 。
(4)为得到纯净的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是 。