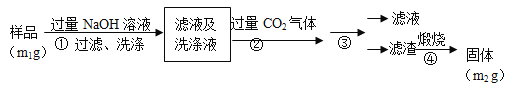
题目内容
【题目】ZrO2常用作陶瓷材料,可由锆英砂(主要成分为ZrSiO4,也可表示为ZrO2·SiO2,还含少量Fe2O3、Al2O3、SiO2等杂质)通过如下方法制取:

已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+。
②部分金属离子在实验条件下开始沉淀和完全沉淀的pH如下表。
金属离子 | Fe3+ | Al3+ | ZrO2+ |
开始沉淀时pH | 1.9 | 3.3 | 6.2 |
沉淀完全时pH | 3.2 | 5.2 | 8.0 |
(1)熔融时ZrSiO4发生反应的化学方程式为 ,滤渣I的化学式为 。
(2)为使滤液I的杂质离子沉淀完全,需用氨水调pH=a,则a的范围是 ;继续加氨水至pH=b时,所发生反应的离子方程式为 。
(3)向过滤III所得滤液中加入CaCO3粉末并加热,得到两种气体。该反应的离子方程式为 。
(4)为得到纯净的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是 。
【答案】(1)ZrSiO4+4NaOH![]() Na2SiO3+Na2ZrO3+2H2O;H2SiO3(或H4SiO4);
Na2SiO3+Na2ZrO3+2H2O;H2SiO3(或H4SiO4);
(2)5.2~6.2;ZrO2++2NH3·H2O+H2O= Zr(OH)4↓+2NH4+;
(3)2NH4++CaCO3![]() Ca2++2NH3↑+CO2↑+H2O;
Ca2++2NH3↑+CO2↑+H2O;
(4)取最后一次洗涤液,向其中滴加稀硝酸,再滴加硝酸银溶液,若无沉淀生成,则Zr(OH)4洗涤干净。
【解析】试题分析:锆英砂(主要成分为ZrSiO4,也可表示为ZrO2SiO2,还含少量Fe2O3、Al2O3、SiO2等杂质)加NaOH熔融,ZrSiO4转化为Na2SiO3和Na2ZrO3,加过量盐酸酸浸,Na2SiO3与HCl生成硅酸沉淀,滤液中含有ZrO2+、Fe3+、Al3+,加氨水调节pH为5.2~6.2,使Fe3+、Al3+转化为氢氧化物沉淀,过滤,滤液中主要含有ZrO2+,再加氨水调节pH使ZrO2+转化为Zr(OH)4沉淀,过滤、洗涤,得到Zr(OH)4,加热分解,即可得到ZrO2;
(1)高温下,ZrSiO4与NaOH反应生成Na2SiO3和Na2ZrO3,其反应的方程式为:ZrSiO4+4NaOH![]() Na2SiO3+Na2ZrO3+2H2O;加过量盐酸酸浸,Na2SiO3与HCl生成硅酸沉淀,过滤,滤渣为H2SiO3;故答案为:ZrSiO4+4NaOH
Na2SiO3+Na2ZrO3+2H2O;加过量盐酸酸浸,Na2SiO3与HCl生成硅酸沉淀,过滤,滤渣为H2SiO3;故答案为:ZrSiO4+4NaOH![]() Na2SiO3+Na2ZrO3+2H2O;H2SiO3;
Na2SiO3+Na2ZrO3+2H2O;H2SiO3;
(2)需用氨水调pH=a,使Fe3+、Al3+转化为氢氧化物沉淀,而ZrO2+不能沉淀,根据表中数据可知:pH在5.2~6.2时Fe3+、Al3+完全沉淀,而ZrO2+不沉淀;加氨水至pH=b时,ZrO2+与NH3H2O反应生成Zr(OH)4沉淀,其反应的离子方程式为:ZrO2++2NH3H2O+H2O=Zr(OH)4↓+2NH4+;故答案为:5.2~6.2;ZrO2++2NH3H2O+H2O=Zr(OH)4↓+2NH4+;
(3)过滤Ⅲ所得滤液中主要含有铵根离子,溶液显酸性,加入CaCO3粉末并加热得到氨气和二氧化碳,其反应的离子方程式为:2NH4++CaCO3![]() Ca2++2NH3↑+CO2↑+H2O;故答案为:2NH4++CaCO3
Ca2++2NH3↑+CO2↑+H2O;故答案为:2NH4++CaCO3![]() Ca2++2NH3↑+CO2↑+H2O;
Ca2++2NH3↑+CO2↑+H2O;
(4)沉淀上附着的杂质为氯离子,用稀硝酸和硝酸银来检验洗液中是否含有氯离子即可,其操作为:取最后一次洗涤液,向其中滴加稀硝酸,再滴加硝酸银溶液,若无沉淀生成,则Zr(OH)4洗涤干净;故答案为:取最后一次洗涤液,向其中滴加稀硝酸,再滴加硝酸银溶液,若无沉淀生成,则Zr(OH)4洗涤干净。

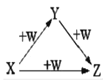
【题目】短周期元素甲、乙、丙、丁、戊在元素周期表中的相对位置如表所示,其中丁所处的主族序数是其周期序数的三倍。回答下列问题:
乙 | 丙 | 丁 | |
甲 | 戊 |
(1)乙在元素周期表中的位置是___________________。
(2)原子半径:戊______甲(填“>”或“<”)。
(3)乙与戊组成化合物的电子式为______,其中化学键的类型是_____(填“极性”或“非极性”)共价键。
(4)元素的非金属性:甲______丙(填“>”或“<”),下列事实能说明该结论的是_______(填字母)。
A.丙的氢化物稳定,甲的氢化物不稳定
B.丙的最高价氧化物对应的水化物是强酸,甲的是弱酸
C.丙的最高价氧化物对应的水化物易溶于水,甲的难溶
(5)工业上制取甲(粗品)的化学方程式为_________________________________。