��Ŀ����
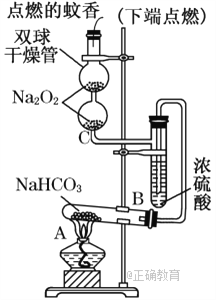
����Ŀ��ұ�������ȼ���״������һ����ҵ������ͼ��ʾ��������������Դ�������ʣ����ٻ�����Ⱦ����ش��������⣺

��1��Ti��ԭ������Ϊ22��Tiλ��Ԫ�����ڱ��е�_______���ڡ�
��2��д���������ڸ������뽹̿���Ȼ��õ����Ȼ��ѵĻ�ѧ����ʽ_______________��
��3���Ʊ�TiO2�ķ���֮һ������TiCl4ˮ������TiO2��x H2O���پ������Ƶá�ˮ��ʱ����������ˮ�����ȣ����ϻ�ѧ����ʽ�ͱ�Ҫ������˵��ԭ��_________________________________________��
��4����TiCl4��Ti ��Ҫ��Ar���н��е�������_________________________________����Ӧ��õ�Mg��MgCl2��Ti�Ļ����ɲ����������ķ�������õ�Ti�������±���Ϣ������ȵ��¶��Ը���___________�����ɡ�
TiCl4 | Mg | MgCl2 | Ti | |
�۵�/�� | ��25.0 | 648.8 | 714 | 1667 |
�е�/�� | 136.4 | 1090 | 1412 | 3287 |
��5����������ԭ�ζ����ⶨTiO2������������һ�������£���TiO2�ܽⲢ��ԭΪTi3+ ������KSCN��Һ��ָʾ������NH4Fe(SO4)2����Һ�ζ�Ti3+��ȫ������Ti4+���ζ�����ʱ����ȡTiO2��Ħ������ΪM g/mol������w g������c mol/L NH4Fe(SO4)2����ҺV mL����TiO2��������Ϊ___________________�����ô���ʽ��ʾ��
��6����CO��H2�ϳɼ״��ķ���ʽ�ǣ�CO(g)��2H2(g) ![]() CH3OH(g)�����������������������ʵ��κ���ʧ��������ҵ����ÿ�ϳ�6mol�״�����������ⲹ��H2 ____mol��
CH3OH(g)�����������������������ʵ��κ���ʧ��������ҵ����ÿ�ϳ�6mol�״�����������ⲹ��H2 ____mol��
���𰸡� �� 2FeTiO3+6C+7Cl2![]() 2FeCl3+ 2TiCl4+6CO TiCl4+(2+x)H2O
2FeCl3+ 2TiCl4+6CO TiCl4+(2+x)H2O![]() TiO2��xH2O+4HCl���������ˮ���������Ȼ���ӷ���ʹƽ�������ƶ����ٽ�ˮ��������ȫ�����ʹˮ����������� ��ֹ�ѡ�þ�����������ֹ��þ�������ˮ��Ӧ�� 1412
TiO2��xH2O+4HCl���������ˮ���������Ȼ���ӷ���ʹƽ�������ƶ����ٽ�ˮ��������ȫ�����ʹˮ����������� ��ֹ�ѡ�þ�����������ֹ��þ�������ˮ��Ӧ�� 1412 ![]() ����
����![]() %�� 5
%�� 5
��������������Ҫ���������Ʊ���̽��ʵ�顣
��1��Ti��ԭ������Ϊ22��Tiλ��Ԫ�����ڱ��е������ڡ�
��2���������ڸ������뽹̿���Ȼ��õ����Ȼ��ѣ�ͬʱ�õ�FeCl3��CO����ѧ����ʽ��2FeTiO3+6C+7Cl2![]() 2FeCl3+2TiCl4+6CO��
2FeCl3+2TiCl4+6CO��
��3��ˮ��ʱ����������ˮ�����ȣ�ԭ��TiCl4+(2+x)H2O![]() TiO2��xH2O+4HCl���������ˮ���������Ȼ���ӷ���ʹƽ�������ƶ����ٽ�ˮ��������ȫ�����ʹˮ�����������
TiO2��xH2O+4HCl���������ˮ���������Ȼ���ӷ���ʹƽ�������ƶ����ٽ�ˮ��������ȫ�����ʹˮ�����������
��4����TiCl4��Ti��Ҫ��Ar���н��е������Ƿ�ֹ�ѡ�þ�����������ֹ��þ�������ˮ��Ӧ������Ӧ��õ�Mg��MgCl2��Ti�Ļ����ɲ����������ķ�������õ�Ti�������±���Ϣ������ȵ��¶��Ը���1412�����ɣ���ʱ�����Mg��MgCl��������Ti��
��5��TiO2��NH4Fe(SO4)2��e-����TiO2��������Ϊ![]() ����
����![]() %����
%����
��6��14NaCl+14H2O![]() 14NaOH+7H2��+7Cl2����2FeTiO3+6C+7Cl2
14NaOH+7H2��+7Cl2����2FeTiO3+6C+7Cl2![]() 2FeCl3+2TiCl4+6CO��6CO(g)��12H2(g)
2FeCl3+2TiCl4+6CO��6CO(g)��12H2(g) ![]() 6CH3OH(g)���ɼ����������������������ʵ��κ���ʧ��������ҵ����ÿ�ϳ�6mol�״�����������ⲹ��H25mol��
6CH3OH(g)���ɼ����������������������ʵ��κ���ʧ��������ҵ����ÿ�ϳ�6mol�״�����������ⲹ��H25mol��

 �㽭��У��ʦ���ϵ�д�
�㽭��У��ʦ���ϵ�д� ȫ�ų��100��ϵ�д�
ȫ�ų��100��ϵ�д�