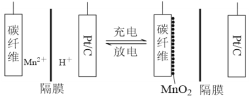
题目内容
【题目】工业上以废铜为原料经一系列化学反应可生产氯化亚铜(CuCl),其工艺流程如下图所示:
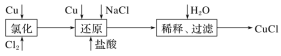
试依据如图转化回答下列问题:
(1)工业生产Cl2时,尾气常用石灰乳吸收,而不用烧碱溶液吸收的原因是_______。
(2)还原过程中的产物为Na[CuCl2],试写出该反应的化学方程式:___________。
(3)合成结束后所得产品用酒精淋洗的目的是_______________。
(4)实验室中在CuCl2热溶液中通入SO2气体也可制备白色的CuCl沉淀,试写出该反应的离子方程式:____。
【答案】石灰乳来源丰富,成本低,且反应结束后可得副产品漂白粉 CuCl2+2NaCl+Cu=2Na[CuCl2] 使CuCl尽快干燥,防止被空气氧化 2Cu2++2Cl-+SO2+2H2O ![]() 2CuCl↓+4H++SO42—
2CuCl↓+4H++SO42—
【解析】
(1)工业生产Cl2时,尾气常用石灰乳吸收,而不用烧碱溶液,可从成本和产品两个方面考虑,从而得出这样操作的原因是石灰乳来源丰富,成本低,且反应结束后可得副产品漂白粉。答案为:石灰乳来源丰富,成本低,且反应结束后可得副产品漂白粉
(2)还原过程中的产物为Na[CuCl2],反应的化学方程式:CuCl2+2NaCl+Cu=2Na[CuCl2]。答案为:CuCl2+2NaCl+Cu=2Na[CuCl2]
(3)若用水洗,后续操作为烘干;若用酒精洗涤,固体表面的酒精自然挥发,不需烘干。因为氯化亚铜性质不稳定,烘干时易被空气中的氧气氧化,所以合成结束后所得产品应用酒精淋洗。答案为:使CuCl尽快干燥,防止被空气氧化
(4)实验室中在CuCl2热溶液中通入SO2气体也可制备白色的CuCl沉淀,该反应的离子方程式:2Cu2++2Cl-+SO2+2H2O ![]() 2CuCl↓+4H++SO42—。
2CuCl↓+4H++SO42—。
答案为:2Cu2++2Cl-+SO2+2H2O ![]() 2CuCl↓+4H++SO42—
2CuCl↓+4H++SO42—

 第1卷单元月考期中期末系列答案
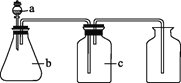
第1卷单元月考期中期末系列答案【题目】下图中a、b、c表示相应仪器中加入的试剂,可用如图装置制取、净化、收集的气体是( )
编号 | 气体 | a | b | c |
|
A | NH3 | 浓氨水 | 生石灰 | 碱石灰 | |
B | CO2 | 盐酸 | 碳酸钙 | 饱和NaHCO3溶液 | |
C | NO | 稀硝酸 | 铜屑 | H2O | |
D | NO2 | 浓硝酸 | 铜屑 | NaOH溶液 |
A. AB. BC. CD. D