题目内容
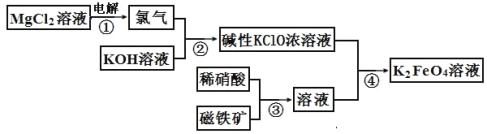
【题目】高铁酸钾的生产流程如图,涉及的离子反应方程式书写错误的是( )
A. 2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B. Cl2+2OH-=Cl-+ClO-+H2O
C. 3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O
D. 2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O
【答案】A
【解析】
A、氯化镁溶液电解:MgCl2+2H2O![]() Cl2↑+H2↑+Mg (OH)2↓,离子反应方程式:Mg2+ +2Cl-+2H2O
Cl2↑+H2↑+Mg (OH)2↓,离子反应方程式:Mg2+ +2Cl-+2H2O![]() Cl2↑+H2↑+Mg (OH)2↓ ,Mg (OH)2是难溶物,不可拆,A错误;
Cl2↑+H2↑+Mg (OH)2↓ ,Mg (OH)2是难溶物,不可拆,A错误;
B、氯气和氢氧化钾溶液反应:Cl2+2KOH=KCl+KClO+H2O,离子反应方程式:Cl2+2OH-=Cl-+ClO-+H2O,B正确;
C、磁铁矿和稀硝酸反应:3Fe3O4+28HNO3(稀)=9Fe(NO3)3+NO↑+14H2O,离子反应方程式:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O,C正确;
D、碱性KClO溶液与Fe(NO3)3溶液反应:3KClO+2Fe(NO3)3+10KOH=2K2FeO4+3KCl+5H2O+ 6KNO3,离子反应方程式:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,D正确。
答案选A。

练习册系列答案
相关题目