题目内容
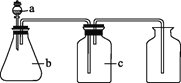
【题目】下图中a、b、c表示相应仪器中加入的试剂,可用如图装置制取、净化、收集的气体是( )
编号 | 气体 | a | b | c |
|
A | NH3 | 浓氨水 | 生石灰 | 碱石灰 | |
B | CO2 | 盐酸 | 碳酸钙 | 饱和NaHCO3溶液 | |
C | NO | 稀硝酸 | 铜屑 | H2O | |
D | NO2 | 浓硝酸 | 铜屑 | NaOH溶液 |
A. AB. BC. CD. D
【答案】B
【解析】
A、浓氨水有挥发性,在加热条件下分解生成氨气,生石灰和水反应放出大量的热,所以可用浓氨水和生石灰制取氨气;碱石灰一般应盛放在干燥管内,氨气的密度小于空气的密度,所以应采用向下排空气法收集,A错误;
B、盐酸和碳酸钙反应生成二氧化碳,盐酸有挥发性,所以生成的二氧化碳中有氯化氢,氯化氢和碳酸氢钠反应生成二氧化碳,饱和的碳酸氢钠和二氧化碳不反应,所以可用饱和碳酸氢钠洗气,二氧化碳的密度大于空气的密度,所以可用向上排空气法收集,B正确;
C、铜和稀硝酸反应生成一氧化氮,一氧化氮和氧气反应生成二氧化氮,所以不能用排空气法收集一氧化氮,C错误;
D、铜和浓硝酸反应生成二氧化氮,浓硝酸有挥发性,所以二氧化氮中有硝酸,硝酸能和碱反应,二氧化氮和碱也反应,所以不能用氢氧化钠洗气,D错误。
答案选B。

【题目】I.下图是抚州市某儿童微量元素体检报告单的部分数据:
抚州市某医疗机构临床检验结果报告单 | ||||
分析项目 | 检测结果 | 单位 | 正常值参考范围 | |
1 | 锌(Zn) | 109.62 | μmol/L | 66-120 |
2 | 铁(Fe) | 5.92↓ | mmol/L | 7.52-11.82 |
3 | 钙(Ca) | 1.68 | mmol/L | 1.55-2.10 |
…… | ||||
根据上表的数据,回答下列问题:
(1)该儿童_____元素含量偏低。
(2)报告单中“μmol/L”是__________(填“质量”、“体积”或“浓度”)的单位。
(3)服用维生素C可使食物中的Fe3+转化为Fe2+。在这个过程中体现维生素C的________(填“氧化性”或“还原性”)。
II. 高铁酸钾(K2FeO4,铁元素为+6价)是一种新型、高效、多功能绿色水处理剂,无二次污染。制备高铁酸钾的离子反应方程式为:___Fe(OH)3+__ClO-+___OH- = ___FeO42-+___Cl-+ __H2O
回答下列问题:
(4)配平该离子方程式。
(5)每生成1molFeO42-转移的电子数为___________,若反应过程中转移了0.3mo1电子,则还原产物的物质的量为________mo1。