题目内容
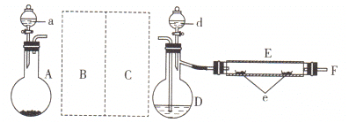
【题目】实验室制备Cl2通常采用如图所示装置:

(1)A装置中发生反应的化学方程式是________;其中氧化剂是_________,每生成1 mol Cl2,被氧化的物质的物质的量是_____mol。
(2)仪器a的名称是_________;
(3)B装置中所盛的试剂是________________,装置C的作用是________________;
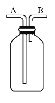
(4)若将下图集气瓶中充满饱和食盐水,代替装置D收集氯气,此时应气体从_______口流入(填“A”或“B”)。
(5)E装置中发生反应的化学方程式是________________________。
(6)将下图装置代替装置D和E,可进行“氯气与金属钠反应”的实验,以下叙述正确的是________。
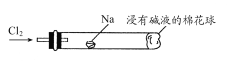
A.反应生成的大量白烟是氯化钠晶体
B.玻璃管尾部塞一团浸有碱液的棉球是用于吸收过量的氯气,以免其污染空气
C.玻璃管中,钠燃烧时会产生苍白色火焰
D.若在棉球外沿滴一滴淀粉碘化钾溶液,可据其颜色变化判断氯气是否被碱液完全吸收
【答案】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O MnO2 2 分液漏斗 饱和食盐水 干燥Cl2 B 2NaOH+Cl2=NaCl+NaClO+H2O ABD
MnCl2+Cl2↑+2H2O MnO2 2 分液漏斗 饱和食盐水 干燥Cl2 B 2NaOH+Cl2=NaCl+NaClO+H2O ABD
【解析】
(1)A装置中二氧化锰与浓盐酸共热反应生成氯化锰、氯气和水;MnO2中Mn元素由+4价降为+2价,MnO2为氧化剂,HCl中氯元素由-1价升为0价作为还原剂;
(2)根据仪器的构造判断;
(3)B装置除去氯气中的氯化氢气体;装置C干燥Cl2;
(4)排液法收集气体时,应该采用短进长出的方法;
(5)氯气有毒,直接排放会污染空气,E装置利用氢氧化钠吸收氯气;
(6)根据实验及氯气性质分析。
(1)A装置中二氧化锰与浓盐酸共热反应生成氯化锰、氯气和水,发生反应的化学方程式是MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;MnO2中Mn元素由+4价降为+2价,MnO2为氧化剂,HCl中氯元素由-1价升为0价作为还原剂;根据反应知,每生成1 mol Cl2,被氧化的物质HCl的物质的量是2mol;
MnCl2+Cl2↑+2H2O;MnO2中Mn元素由+4价降为+2价,MnO2为氧化剂,HCl中氯元素由-1价升为0价作为还原剂;根据反应知,每生成1 mol Cl2,被氧化的物质HCl的物质的量是2mol;
(2)根据仪器的构造可知,仪器a的名称是分液漏斗;
(3)B装置中所盛的试剂是饱和食盐水,以除去氯气中的氯化氢气体;装置C装有浓硫酸,其作用是干燥Cl2;
(4)若将下图集气瓶中充满饱和食盐水,代替装置D收集氯气,排液法收集气体时,应该采用短进长出的方法,即此时应气体从B口流入;
(5)氯气有毒,直接排放会污染空气,E装置利用氢氧化钠吸收氯气,发生反应的化学方程式为2NaOH+Cl2=NaCl+NaClO+H2O;
(6)A、反应生成的大量白烟是氯化钠晶体,选项A正确;
B、NaOH与氯气反应,可吸收过量的氯气,以免其污染空气,选项B正确;
C、钠着火燃烧产生黄色火焰,选项C错误;
D、当浸有淀粉KI溶液的棉球未变色,表明氯气已被碱液完全吸收,选项D正确;
答案选ABD。

 名校课堂系列答案
名校课堂系列答案