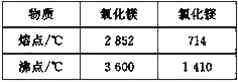
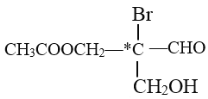题目内容
【题目】X、Y、Z、W四种物质间的转化关系如图所示 ,下列转化不能一步实现的是
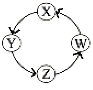
序号 | X | Y | Z | W |
A | N2 | NH3 | NO | NO2 |
B | Na | NaOH | Na2CO3 | NaCl |
C | Cl2 | Ca(ClO)2 | HClO | HCl |
D | H2S | S | SO3 | H2SO4 |
A.AB.BC.CD.D
【答案】D
【解析】
A. 氮气与氢气反应可以一步制得氨气,氨气与氧气发生催化氧化可一步得到一氧化氮,NO与氧气反应可一步得到NO2,二氧化氮与一氧化碳反应可得到氮气(汽车尾气处理装置), 故A能一步实现;
B. Na与水反应可得到NaOH,NaOH与二氧化碳反应可得到碳酸钠,碳酸钠与氯化钡反应可得到氯化钠,电解熔融氯化钠可得到钠单质,故B能一步实现;
C. 氯气可与氢氧化钙反应得到次氯酸钙,次氯酸钙可与水和二氧化碳反应得到HClO,HClO分解可得HCl,浓盐酸与二氧化锰反应可得到氯气,故C能一步实现;
D. 硫化氢被氧化可得到硫单质,硫单质无法一步反应制得SO3,三氧化硫溶于水可得到H2SO4,故D不能一步实现;
故选D。

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案【题目】某化学兴趣小组对硫酸亚铁的一些性质进行探究。 回答下列问题:
(1)配制 0.5 mol·L-1 FeSO4 溶液时,将称量好的硫酸亚铁溶解于一定浓度的稀硫酸溶液中,结合化学用语解释稀硫酸的作用____。该实验小组做如下实验。
实验序号 | 操作及现象 |
ⅰ | 取 2 mL 上述 FeSO4 溶液于试管中,逐滴加入少量 0.1 mol·L-1 Na2S 溶液,产生大量黑色沉淀 |
ⅱ | 取 2 mL 上述 FeSO4 溶液于试管中,加入 2 滴 1 mol·L-1 KSCN 溶液无现象,通入一段时间 O2,溶液变为浅红色 |
ⅲ | 重复实验ⅱ,向浅红色溶液中加入 5% H2O2 溶液至过量,产生无色气体(经检验为O2),溶液变为深红色,且红色很快褪去 |
(2)进一步研究证实,黑色沉淀的主要成分是 FeS。Na2S 溶液呈碱性,FeSO4 溶液与其反应不生成 Fe(OH)2而生成 FeS 的可能原因是_____。
(3)用离子方程式表示步骤ⅱ中溶液变红的原因:______、_____。
(4)甲同学探究步骤ⅲ中溶液褪色的原因,提出如下假设:
a.Fe3+ 被H2O2 还原 b.SCN- 被O2 氧化 c.SCN- 被H2O2 氧化
乙同学根据上述实验现象认为假设 b 不成立,他依据的现象是_____,甲同学利用上述部分试剂,通过以下实验验证了假设 c 成立。请将以下实验操作及现象补充完整。
步骤 | 试剂及操作 | 现 象 |
i | 取褪色后溶液一份滴加 FeCl3 溶液 | ① ___ |
ii | ② ___ | ③ ___ |
(5)为探究硫酸亚铁的分解产物,将硫酸亚铁放入装置 A 接入下图所示的装置中,打开 K1 和 K2,缓缓通入N2,加热。实验后反应管中残留固体为红棕色粉末。C、D 中的溶液依次是 BaCl2 溶液和品红溶液,现象依次出现白色沉淀和品红褪色,写出硫酸亚铁高温分解反应的化学方程式________。