题目内容
【题目】已知:邻苯二甲酸(H2A)的Ka1=1.1×10-3,Ka2=3.9×10-6。室温下,用0.1 mol·L-1 NaOH溶液滴定20 mL 0.1 mol·L-1邻苯二甲酸氢钾(KHA)溶液。下列说法正确的是( )
A.0.1 mol·L-1 KHA溶液中:c(K+)>c(HA-)+2c(A2-)
B.加入NaOH溶液至pH=8时:c(K+)>c(A2-)>c(HA-)>c(H2A)
C.加入20 mL NaOH溶液时:c(OH-)+c(A2-)=c(Na+)+c(H+)+c(H2A)
D.在滴定过程中,水的电离程度一直减小
【答案】BC
【解析】
A.由题可知常温下![]() ,
,![]() ,因此
,因此![]() ,所以KHA的溶液中HA-的电离程度大于其水解程度,溶液显酸性即:
,所以KHA的溶液中HA-的电离程度大于其水解程度,溶液显酸性即:![]() ,根据KHA溶液中的电荷守恒式:
,根据KHA溶液中的电荷守恒式:![]() ,可得
,可得![]() ,A项错误;
,A项错误;
B.由题可知常温下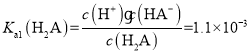 ,
,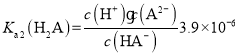 ,pH=8时,
,pH=8时,![]() ,因此可得,
,因此可得,![]() ,
,![]() ,B项正确;
,B项正确;
C.KHA溶液的初始浓度为0.1mol/L,体积为20mL;因此加入20mL,浓度为0.1mol/L的NaOH溶液后,有物料守恒关系式为:![]() ;溶液中的电荷守恒关系式为:
;溶液中的电荷守恒关系式为:![]() ;联立两个式子可得
;联立两个式子可得![]() ,C项正确;
,C项正确;
D.通过分析可知,KHA的溶液中水的电离总体上受抑制,滴定过程中,KHA逐渐转变为A2-,A2-会促进水的电离;因此,滴定过程中水的电离程度逐渐增加,至滴定终点时水的电离程度达到最大,D项错误;
答案选BC。

【题目】Ⅰ.火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知:0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256 kJ的热量。
(1)该反应的热化学方程式为_______________________________________。
(2)又知H2O(l)=H2O(g) ΔH=+44 kJ·mol-1,则16 g液态肼与液态双氧水反应生成液态水时放出的热量是________kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外还有一个很大的优点是________________________。
Ⅱ.参考下列图表和有关要求回答问题。
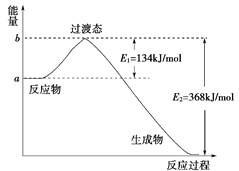
(1)如图是1 mol NO2(g)和1 mol CO(g)反应生成CO2(g)和NO(g)过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:__________________________________;
(2)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能/(kJ/mol) | a | b | c | x |
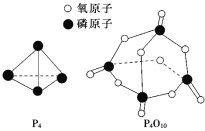
已知白磷的燃烧热ΔH=-d kJ/mol,白磷及其完全燃烧的产物结构如图所示,则上表中x=______________________(用含有a、b、c、d的代数式表示)。
【题目】下列有关实验操作、现象和结论都正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 稀硝酸溶液中加入过量铁粉充分反应后,滴加KSCN溶液 | 溶液变为血红色 | 稀硝酸具有氧化性,能将Fe氧化成Fe3+ |
B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3·H2O能大量共存 |
C | 向某溶液中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口 | 试纸变蓝 | 该溶液中存在NH4+ |
D | 向含有酚酞的Na2CO3溶液中加入少量的BaCl2固体 | 溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
A. AB. BC. CD. D